ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 17.11.2021
Просмотров: 1092
Скачиваний: 1
СОДЕРЖАНИЕ
Протипожежне скло – армоване скло.
Організація та методика проведення лабораторних робіт
4. Постійно стежить за справністю машин і приладів, проводить їх профілактичний і поточний ремонти.
5. Виконує інші роботи за завданням завідувача лабораторіями.
Дозволяє виявити і визначити дефекти, що виникли на різних етапах виробництва литих, кованих, штампованих і катаних заготовок, а також причини руйнування деталей.
Встановлюють: вид зламу (в'язкий, крихкий); величину, форму і розташування зерен і дендритів литого металу; дефекти, що порушують суцільність металу (усадкову пористість, газові пухирці, раковини, тріщини); хімічну неоднорідність металу, викликану процесами кристалізації або створену термічною і хіміко-термічною обробкою; волокна в деформованому металі.
2. Мікроструктурний аналіз – вивчення поверхні за допомогою світлових мікроскопів. Збільшення – 50–2000 разів. Дозволяє виявити елементи структури розміром до 0,2 мкм.
Зразки – мікрошліфи з блискучою полірованою поверхнею, оскільки структура розглядається у відбитому світлі. Спостерігають за мікротріщинами і неметалевими включеннями.
Для виявлення мікроструктури поверхню протравлюють реактивами, що залежать від складу сплаву. Різні фази протравлюються неоднаково і забарвлюються по-різному. Можна виявити форму, розміри й орієнтування зерен, окремі фази і структурні складові.
Окрім світлових мікроскопів використовують електронні мікроскопи з великою роздільною здатністю.
Зображення формується за допомогою швидкого потоку електронів. Електронні промені з довжиною хвилі (0,04–0,12) ·108 см дають можливість розрізняти деталі об'єкту, що за своїми розмірами відповідають міжатомним відстаням.
Растрові мікроскопи. Зображення створюється за рахунок вторинної емісії електронів, що випромінюються поверхнею, на яку падає потік первинних електронів, що безперервно переміщається по цій поверхні. Вивчається безпосередньо поверхня металу. Роздільна здатність дещо нижче, ніж у мікроскопів, що просвічують.
3. Для вивчення атомно-кристалічної будови твердих тіл (тонка будова) використовуються рентгенографічні методи, що дозволяють встановлювати зв'язок між хімічним складом, структурою і властивостями тіла, тип твердих розчинів, мікронапруги, концентрацію дефектів, щільність дислокацій.
3.6. Фізичні методи дослідження
1. Термічний аналіз заснований на явищі теплового ефекту. Фазові перетворення в сплавах супроводжуються тепловим ефектом, у результаті на кривих охолодження сплавів за температур фазових перетворень спостерігаються точки перегину, або температурні зупинки. Даний метод дозволяє визначити критичні точки.
2. Дилатометричний метод.
У процесі нагрівання металів і сплавів відбувається зміна об'єму і лінійних розмірів – теплове розширення. Якщо зміни обумовлені тільки збільшенням енерґії коливань атомів, то під час охолодження розміри відновлюються. За фазових перетворень зміни розмірів є незворотними.
Метод дозволяє визначити критичні точки сплавів, температурні інтервали існування фаз, а також вивчати процеси розпаду твердих розчинів.
Розділ
4. Загальна теорія сплавів.
Будова,
кристалізація і властивості сплавів.
Діаграма стану
4.1. Поняття про сплави і методи їх отримання
Під сплавом розуміють речовину, отриману сплавом двох або більше елементів. Існують й інші способи виготовлення сплавів: спікання, електроліз, сублімація. В цьому випадку речовини називаються псевдосплавами.
Сплав, виготовлений переважно з металевих елементів і який має металеві властивості, називається металевим сплавом. Сплави мають комплекс різних властивостей, що змінюються залежно від складу і методу обробки.
Основні поняття в теорії сплавів
Система – група тіл, що виділяються для спостереження і вивчення.
У металознавстві системами є метали і металеві сплави. Чистий метал є простою однокомпонентною системою, сплав – складною системою, що складається з двох і більше компонентів.
Компоненти – речовини, що утворюють систему. Як компоненти виступають чисті речовини і хімічні сполуки, якщо вони не дисоціюють на складові частини в досліджуваному інтервалі температур.
Фаза – однорідна частина системи, відокремлена від інших частин системи поверхнею розділу, під час переходу через яку структура і властивості різко змінюються.
Варіантність (C) (міра вільності) – це число внутрішніх і зовнішніх чинників (температура, тиск, концентрація), які можна змінювати без зміни кількості фаз у системі.
Якщо варіантність C = 1 (моноваріантна система), то можлива зміна одного з чинників у деяких межах без зміни числа фаз.
Якщо варіантність C = 0 (нонваріантна система), то зовнішні чинники змінювати не можна без зміни числа фаз у системі.
Існує математичний зв'язок між числом компонентів (К), числом фаз (Ф) і варіантністю системи (С).
Це правило фаз, або закон Гіббса:
С = К – Ф +2.
Якщо прийняти, що всі перетворення відбуваються за постійного тиску, то число змінних зменшиться:
С = К – Ф +1,
де С – варіантність системи,
К – число компонентів,
Ф – число фаз,
1 – враховує можливість зміни температури.
4.2. Особливості будови, кристалізації і властивостей сплавів: механічних сумішей, твердих розчинів, хімічних сполук
Будова
металевого сплаву залежить від того, в
які взаємодії вступають компоненти,
складові сплаву. Майже всі метали в
рідкому стані розчиняються один в одному
в будь-яких співвідношеннях.
У процесі
утворення сплавів під час їх твердіння
можлива різна взаємодія компонентів.
Залежно від характеру взаємодії компонентів, розрізняють сплави:
-
механічні суміші,
-
хімічні сполуки,
-
тверді розчини.
Сплави механічні суміші утворюються, коли компоненти взаємно не розчиняються в твердому стані і не вступають у хімічну реакцію з утворенням з'єднання.
Утворюються механічні суміші між елементами, що значно розрізняються за будовою і властивостями, коли сила взаємодії між однорідними атомами більша, ніж між різнорідними. Сплав складається з кристалів компонентів, що входять до його складу (рис. 4.1). У сплавах зберігаються кристалічні решітки компонентів.
А,
В
– компоненти
сплаву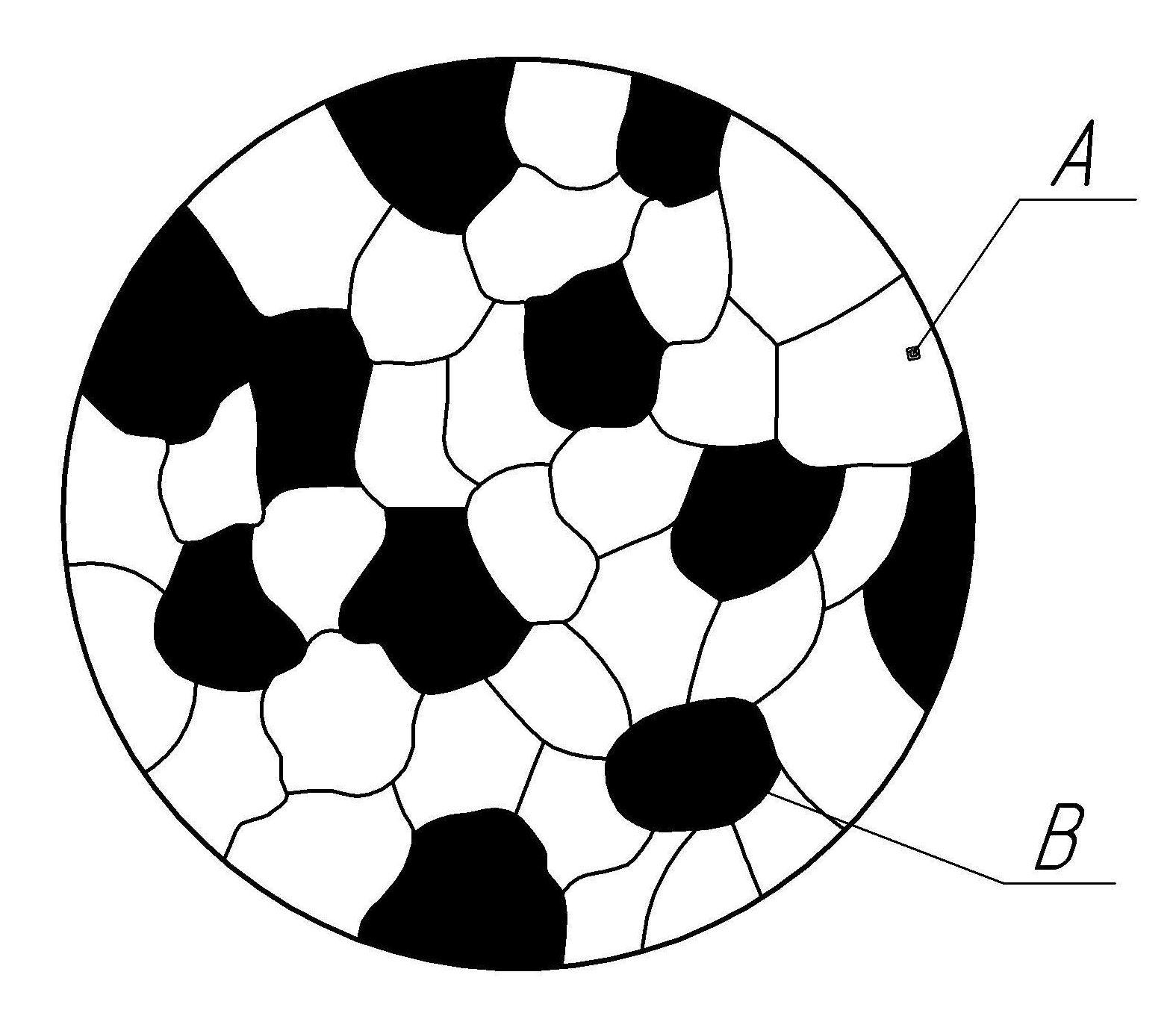
Рис. 4.1. Схема мікроструктури механічної суміші
Сплави хімічні сполуки утворюються між елементами, що значно розрізняються за будовою і властивостями, якщо сила взаємодії між різнорідними атомами більша, ніж між однорідними.
Особливості цих сплавів:
-
Постійність складу, тобто сплав утворюється за певного співвідношення компонентів; хімічна сполука позначається Аn Вm.
-
Утворюється специфічна кристалічна решітка з правильним впорядкованим розташуванням атомів, що відрізняється від ґрат елементів, з яких складаються хімічні сполуки (рис. 4.2).
-
Яскраво виражені індивідуальні властивості.
-
Постійність температури кристалізації, як у чистих компонентів.
Рис. 4.2. Кристалічна решітка хімічної сполуки
Сплави тверді розчини – це тверді фази, в яких співвідношення між компонентами можуть змінюватися; вони є кристалічними речовинами.
Характерною особливістю твердих розчинів є наявність в їх кристалічній решітці різнорідних атомів за збереження типу ґрат розчинника.
Твердий розчин складається з однорідних зерен (рис. 4.3).
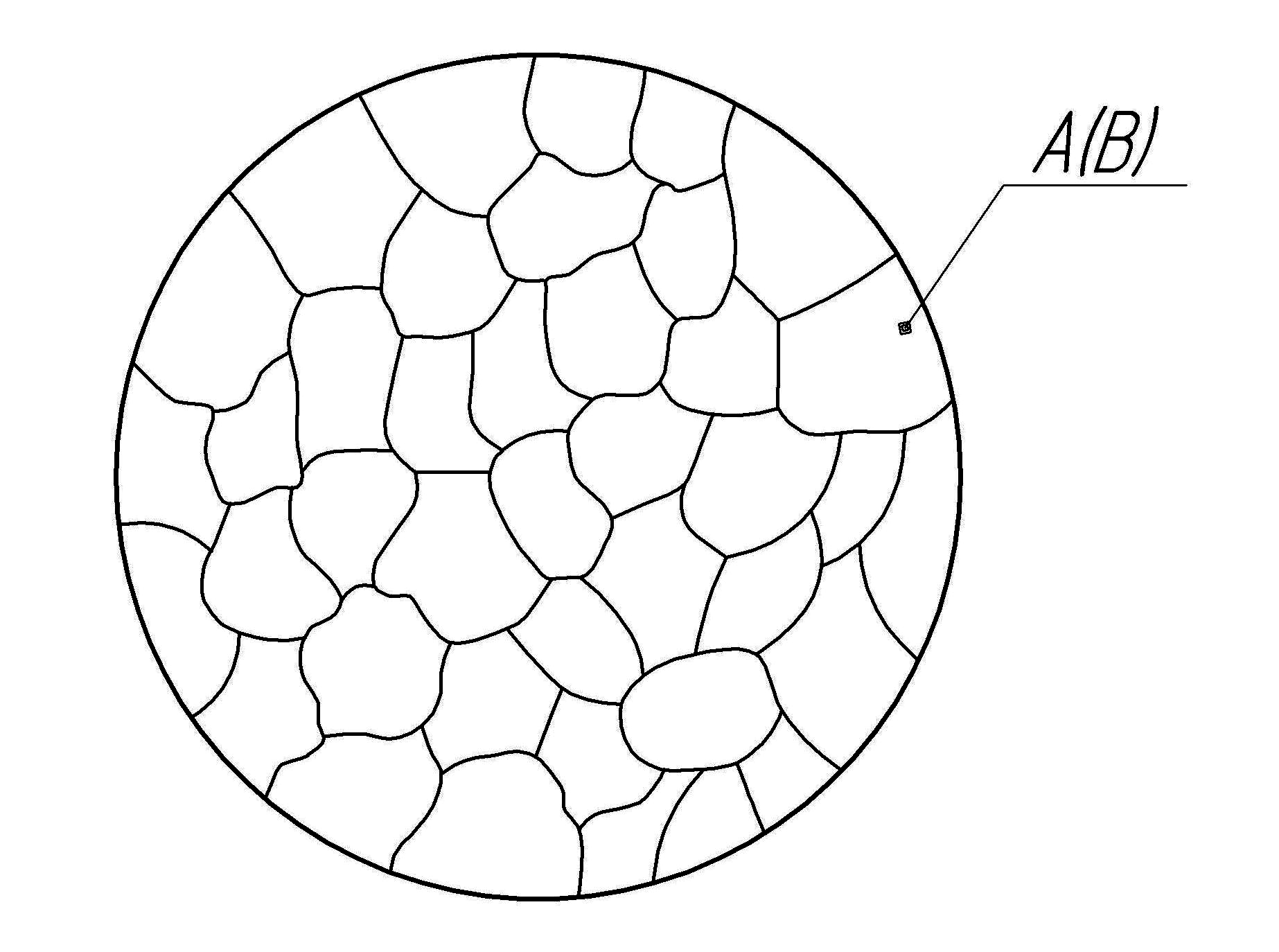
Рис. 4.3. Схема мікроструктури твердого розчину
4.3. Класифікація сплавів твердих розчинів
За ступенями розчинності компонентів розрізняють тверді розчини:
-
з необмеженою розчинністю компонентів,
-
з обмеженою розчинністю компонентів.
За необмеженої розчинності компонентів кристалічна решітка компоненту-розчинника у міру збільшення концентрації розчиненого компоненту плавно переходить у кристалічну решітку розчиненого компоненту.
Для утворення розчинів із необмеженою розчинністю необхідні:
-
Ізоморфність (однотипність) кристалічних решіток компонентів;
-
Близькість атомних радіусів компонентів, які не повинні відрізнятися більше ніж на 8–13 %.
-
Близькість фізико-хімічних властивостей подібних за будовою валентних оболонок атомів.
За обмеженої розчинності компонентів можлива концентрація розчиненої речовини до певної межі. За подальшого збільшення концентрації однорідний твердий розчин розпадається з утворенням двофазної суміші.
За характером розподілу атомів розчиненої речовини в кристалічній решітці розчинника розрізняють тверді розчини:
-
заміщення,
-
занурення,
-
віднімання.
У розчинах заміщення в кристалічній решітці розчинника частина його атомів заміщена атомами розчиненого елементу (рис. 4.4 а). Заміщення здійснюється у випадкових місцях, тому такі розчини називають неврегульованими твердими розчинами.
У процесі утворення розчинів заміщення періоди ґрат змінюються залежно від різниці атомних діаметрів розчиненого елементу і розчинника. Якщо атом розчиненого елементу більше атома розчинника, то елементарні осередки збільшуються, якщо менше – скорочуються. У першому наближенні, ця зміна пропорційна концентрації розчиненого компоненту. Зміна параметрів ґрат під час утворення твердих розчинів – важливий момент, що визначає зміну властивостей. Зменшення параметру веде до більшого зміцнення, ніж його збільшення.
а) б)
Рис.
4.4. Кристалічна решітка твердих розчинів
заміщення (а), занурення (б)
Тверді розчини занурення утворюються зануренням атомів розчиненого компоненту в пори кристалічної решітки розчинника (рис. 4.4 б).
Утворення таких розчинів можливо, якщо атоми розчиненого елементу мають малі розміри. Такими є елементи, що знаходяться на початку періодичної системи Д. І. Менделєєва, – вуглець, водень, азот, бор. Розміри атомів перевищують розміри міжатомних проміжків у кристалічній решітці металу, що викликає спотворення ґрат і в них виникає напруга. Концентрація таких розчинів не перевищує 2–2,5 %.
Тверді розчини віднімання (або розчини з дефектними ґратами) утворюються на базі хімічних сполук. Можливою є не тільки заміна одних атомів у вузлах кристалічної решітки іншими, але й утворення порожніх, не зайнятих атомами, вузлів у ґратах.
До хімічної сполуки додають один з елементів, що входить до формули; його атоми займають нормальне положення в ґратах з'єднання, а місця атомів іншого елементу залишаються незайнятими.
Кристалізація сплавів
Кристалізація сплавів підпорядкована тим же закономірностям, що і кристалізація чистих металів. Необхідною умовою є прагнення системи до стану з мінімумом вільної енерґії.
Основною відмінністю є велика роль дифузійних процесів між рідиною і фазою, що кристалізується. Ці процеси необхідні для перерозподілу різнорідних атомів, рівномірно розподілених у рідкій фазі.
У сплавах у твердих станах мають місце процеси перекристалізації, зумовлені алотропічними перетвореннями компонентів сплаву, розпадом твердих розчинів, виділенням із твердих розчинів вторинних фаз, коли розчинність компонентів у твердому стані міняється зі зміною температури.
За перекристалізації в твердому стані утворюються центри кристалізації і відбувається їх зростання.
Зазвичай центри кристалізації виникають по межах зерен старої фази, де ґрати мають найбільш дефектну будову і де є домішки, які можуть стати центрами нових кристалів. У старої і нової фази протягом деякого часу є загальні площини. Такий зв'язок ґрат називається когерентним зв'язком. У разі відмінності будови старої і нової фаз перетворення протікає з утворенням проміжних фаз.
Порушення когерентності і відособлення кристалів настає, коли вони отримують певні розміри. Процеси кристалізації сплавів вивчаються за діаграмами стану.
Діаграма стану є графічним зображенням стану будь-якого сплаву системи, що вивчається, залежно від концентрації і температури (рис. 4.5).
В
Рис. 4.5. Діаграма стану
Діаграми стану показують стійкі стани, тобто стани, які за даних умов володіють мінімумом вільної енерґії, і тому її також називають діаграмою рівноваги, оскільки вона показує, які за даних умов існують рівноважні фази.
У результаті отримують серію кривих охолоджування, на яких за температур фазових перетворень спостерігаються точки перегину і температурні зупинки.
Температури, що відповідають фазовим перетворенням, називають критичними точками. Деякі критичні точки мають назви, наприклад, точку, що відповідає початку кристалізації, називають точкою ліквідус, а кінцю кристалізації – точка солідус.
За кривими охолодження будують діаграму стану в координатах: за віссю абсцис – концентрація компонентів, за віссю ординат – температура.
Шкала концентрацій показує вміст компоненту В. Основними лініями є лінії ліквідус (1) і солідус (2), а також лінії, що відповідають фазовим перетворенням у твердому стані (3, 4).
За діаграмою стану можна визначити температури фазових перетворень, зміну фазового складу, приблизно, властивості сплаву, види обробки, які можна застосовувати для даного сплаву.