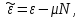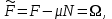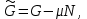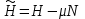ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 10.11.2023
Просмотров: 18
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
«Термодинамические потенциалы»
План:
-
Группа потенциалов “E F G H”, имеющих размерность энергии. -
Зависимость термодинамических потенциалов от числа частиц. Энтропия как термодинамический потенциал. -
Термодинамические потенциалы многокомпонентных систем. -
Практическая реализация метода термодинамических потенциалов (на примере задачи химического равновесия).
1.
Один из основных методов современной термодинамики является метод термодинамических потенциалов. Этот метод возник, во многом, благодаря использованию потенциалов в классической механике, где его изменение связывалось с производимой работой, а сам потенциал является энергетической характеристикой термодинамической системы. Исторически сложилось так, что введенные первоначально термодинамические потенциалы также имели размерность энергии, что и определило их название.
Упомянутая группа включает следующие системы:
- внутренняя энергия
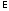 ;
;- свободная энергия или потенциал Гельмгольца
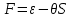 ;
;- термодинамический потенциал Гиббса
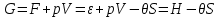 ;
;- энтальпия
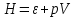 .
.Потенциальность внутренней энергии
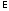 была показано в предыдущей теме. Из нее следует потенциальность остальных величин.
была показано в предыдущей теме. Из нее следует потенциальность остальных величин.Дифференциалы термодинамических потенциалов принимает вид:
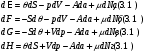
Из соотношений (3.1) видно, что соответствующие термодинамические потенциалы характеризуют одну и ту же термодинамическую систему при различных способах …. описания (способах задания состояния термодинамической системы). Так, для адиабатически изолированной системы, описываемой в переменных
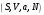 удобно в качестве термодинамического потенциала использовать внутреннюю энергию
удобно в качестве термодинамического потенциала использовать внутреннюю энергию  .Тогда параметры системы, термодинамически сопряженные к потенциалам, определяются из соотношений:
.Тогда параметры системы, термодинамически сопряженные к потенциалам, определяются из соотношений: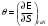 ,
, 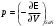 ,
, 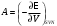
,
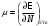 (3.2)
(3.2)Если в качестве способа описания используется “система в термостате”, задаваемая переменными
 , наиболее удобно использовать в качестве потенциала свободную энергию
, наиболее удобно использовать в качестве потенциала свободную энергию 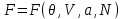 . Соответственно, для параметров системы получим:
. Соответственно, для параметров системы получим: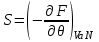 ,
, 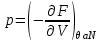 ,
, 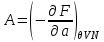 ,
, 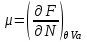 (3.3)
(3.3)Далее, выберем в качестве способа описания модель “системы под поршнем”. В этих случаях функции состояния образуют набор (
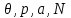 ), а в качестве термодинамического потенциала используется потенциал Гиббса G. Тогда параметры системы определяются из выражений:
), а в качестве термодинамического потенциала используется потенциал Гиббса G. Тогда параметры системы определяются из выражений: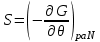 ,
, 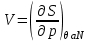 ,
, 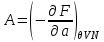 ,
, 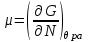 (3.4)
(3.4)И в случае “адиабатической системы над поршнем”, заданной функциями состояния
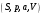 роль термодинамического потенциала играет энтальпия H. Тогда параметры системы принимают вид:
роль термодинамического потенциала играет энтальпия H. Тогда параметры системы принимают вид: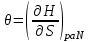 ,
, 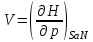 ,
, 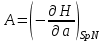 ,
, 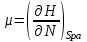 (3.5)
(3.5)Из того, что соотношения (3.1) задают полные дифференциалы термодинамических потенциалов, мы можем приравнивать их вторые производные.
Например,
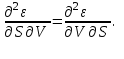 Учитывая, что
Учитывая, что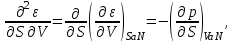
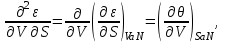
получаем
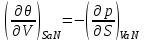 (3.6а)
(3.6а)Аналогично для остальных параметров системы, связанных с термодинамическим потенциалом
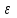 , запишем:
, запишем:
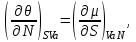
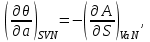
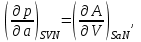
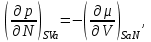
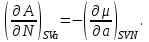 (3.6б-е)
(3.6б-е)Подобные тождества можно записать и для других наборов параметров термодинамического состояния системы на основе потенциальности соответствующих термодинамических функций
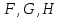 .
.Так, для “системы в термостате” c потенциалом
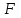 , имеем:
, имеем:
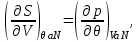
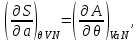
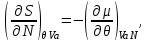
(3.7)

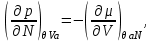
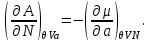
Для системы “над поршнем” с потенциалом Гиббса
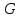 будут справедливы равенства:
будут справедливы равенства: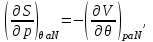
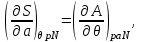
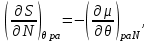
(3.8)
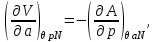
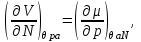

И, наконец, для системы с адиабатическим поршнем с потенциалом H, получим:
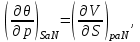
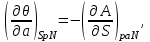
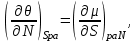
(3.9)
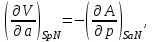
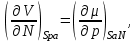
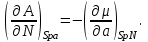
Равенства вида (3.6) – (3.9) получили название термодинамических тождеств и в ряде случаев оказываются удобными для практических расчетов.
Использование термодинамических потенциалов позволяет достаточно просто определить работу системы
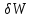 и тепловой эффект
и тепловой эффект 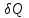 .
.Так, из соотношений (3.1) следует:
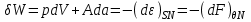 (3.10)
(3.10)Из первой части равенства следует известное положение о том, что работа теплоизолированной системы (
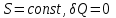 ) производится за счет убыли ее внутренней энергии. Второе равенство означает, что свободная энергия
) производится за счет убыли ее внутренней энергии. Второе равенство означает, что свободная энергия  есть та часть внутренней энергии
есть та часть внутренней энергии  , которая при изотермическом процессе
, которая при изотермическом процессе 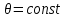 целиком переходит в работу (соответственно “оставшуюся” часть внутренней энергии
целиком переходит в работу (соответственно “оставшуюся” часть внутренней энергии 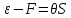 иногда называют связанной энергией).
иногда называют связанной энергией).Количество теплоты
 можно представить в виде:
можно представить в виде: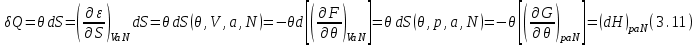 Из последнего равенства понятно, почему энтальпию еще называют теплосодержанием. При горении и других химических реакциях, происходящих при постоянном давлении (
Из последнего равенства понятно, почему энтальпию еще называют теплосодержанием. При горении и других химических реакциях, происходящих при постоянном давлении (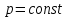 ), выделяемое количество теплоты равно изменению энтальпии.
), выделяемое количество теплоты равно изменению энтальпии. Выражение (3.11), с учетом второго начала термодинамики (2.7) позволяет определить теплоемкость:
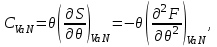
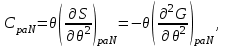
(3.12)
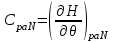
Все термодинамические потенциалы типа энергии обладают свойством аддитивности. Поэтому можно записать:
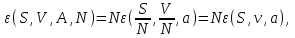
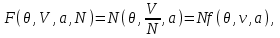 (3.13)
(3.13)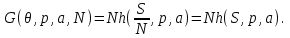
Легко видеть, что потенциал Гиббса содержит только один аддитивный параметр
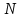 , т.е. удельный потенциал Гиббса
, т.е. удельный потенциал Гиббса 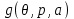 от
от
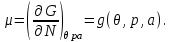 (3.14)
(3.14)То есть химический потенциал есть удельный потенциал Гиббса, и имеет место равенство
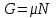 (3.15)
(3.15) Термодинамические потенциалы (3.1) связаны между собой прямыми соотношениями, позволяющими совершать переход от одних потенциалов к другим. Например, выразим все термодинамические потенциалы через внутреннюю энергию.
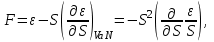
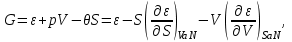 (3.16)
(3.16)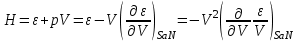
При этом мы получили все термодинамические потенциалы как функции (
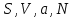 ). Для того, чтобы выразить их в других переменных, используют процедуру пере….
). Для того, чтобы выразить их в других переменных, используют процедуру пере….Пусть задано давление
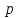 в переменных (
в переменных (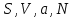 ):
):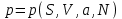 (3.17)
(3.17)Запишем последнее выражение в виде уравнения состояния, т.е. найдем вид
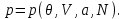
Легко видеть, что если состояние задано в переменных (
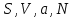 ), то термодинамическим потенциалом является внутренняя энергия
), то термодинамическим потенциалом является внутренняя энергия 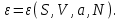 В силу (3.2) найдем
В силу (3.2) найдем 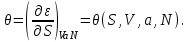 (3.18)
(3.18)Рассматривая (3.18) как уравнение относительно S, находим его решение:
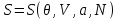 (3.19)
(3.19)Подставляя (3.19) в (3.17) получаем
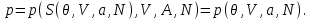 (3.20)
(3.20)То есть от переменных (
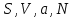 ) мы перешли к переменным (
) мы перешли к переменным (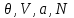 ).
).2.
Вторая группа термодинамических потенциалов возникает в том случае, если в качестве термодинамических переменных, помимо рассмотренных выше, включен химический потенциал
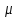 . Потенциалы второй группы также имеют размерность энергии и могут быть связаны с потенциалами первой группы путем соотношений:
. Потенциалы второй группы также имеют размерность энергии и могут быть связаны с потенциалами первой группы путем соотношений: