Файл: Методические указания Печатается по решению учебнометодической комиссии химического факультета Иркутского государственного.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 22.11.2023
Просмотров: 56
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
Федеральное агентство по образованию
ГОУ ВПО «Иркутский государственный университет»
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Часть 2
Электрохимические методы анализа
Методические указания

Печатается по решению учебно-методической комиссии
химического факультета Иркутского государственного
университета
Рецензент: канд. хим. наук, доц. П. Б. Крайкивский
Составители: канд. хим. наук, доц. Н. Ф. Апрелкова,
канд. хим. наук, доц. Г. Н. Королева,
канд. хим. наук, доц. Д. А. Матвеев,
канд. хим. наук, доц. Г. Б. Недвецкая
Методические указания составлены в соответствии с программой курса аналитической химии для университетов. Основная цель – ознакомить студентов с электрохимическими методами анализа, знание которых является необходимым в процессе формирования специалиста-химика. Предназначаются для студентов 3-го курса химического факультета, выполняющих лабораторные работы по общему курсу «Аналитическая химия» (часть 2 «Физико-химические методы анализа»).
Содержание
ВВЕДЕНИЕ 4
1. ЭЛЕКТРОГРАВИМЕТРИЯ 5
1.1.Законы электролиза 6
1.2. Виды поляризации электродов 7
1.3. Напряжение разложения 8
1.4. Перенапряжение 8
1.5. Разновидности электролиза 9
Лабораторная работа 1. Электровесовое определение меди
и свинца при совместном присутствии 12
Лабораторная работа 2. Определение меди в дюралюминии
методом внутреннего электролиза 13
2. ВОЛЬТАМПЕРОМЕТРИЯ 14
2.1. Прямые методы вольтамперометрии 15
2.1.1. Классическая полярография 15
2.1.2. Осциллографическая полярография 22
Лабораторная работа 3. Определение ионов таллия и цинка
при совместном присутствии методом классической
полярографии 26
Лабораторная работа 4. Определение малых концентраций
ионов кадмия на осциллографическом полярографе 28
3. ПОТЕНЦИОМЕТРИЯ 29
3.1. Прямые методы потенциометрии. рН-метрия 31
3.2. Косвенные методы потенциометрии.
Потенциометрическое титрование 34
Лабораторная работа 5. Потенциометрическое определение
соляной и уксусной кислот при совместном присутствии 35
Лабораторная работа 6. Раздельное определение соляной
и серной кислот в их смеси потенциометрическим титрованием
в неводной среде
38
4. КОНДУКТОМЕТРИЯ 41
Лабораторная работа 7. Определение соляной кислоты
в растворе методом кондуктометрического титрования 48
Лабораторная работа 8. Кондуктометрическое определение
серной кислоты и сульфата меди в смеси 50
ЛИТЕРАТУРА 51
ВВЕДЕНИЕ
Современная аналитическая химия широко использует физико-химические и физические методы анализа. Среди физико-химических методов большое место занимают электрохимические (ЭХМА).
Электрохимические методы – это методы качественного и количественного определения веществ, основанные на протекании реакций либо на электродах, либо в приэлектродном пространстве, связанные с изменением структуры, химического состава или концентрации вещества.
В соответствии с областями электрохимических измерений ЭХМА выделяют:
1. Электрогравиметрию (электролиз) – метод, основанный на выделении из растворов электролитов веществ, осаждающихся на электродах при прохождении через растворы постоянного электрического тока.
2. Вольтамперометрию – это группа методов, в которых контролируемый параметр – потенциал рабочего электрода – меняется во времени, а измеряемой величиной является ток, протекающий через рабочий электрод. Основной частью вольтамперометрии является полярография.
3. Потенциометрию – метод, основанный на зависимости потенциала индикаторного электрода от активности определяемого компонента.
4. Кондуктометрию – метод, основанный на измерении электропроводности электролитов, т. е. ионных проводников, находящихся в виде расплавов, коллоидных и истинных водных и неводных растворов.
ЭХМА, как и другие методы анализа, могут быть прямыми, когда по физическому параметру судят о концентрации Р = f(C). При этом определение концентрации ведется либо непосредственно по шкале прибора, либо по графику или по расчетной формуле. Второй вариант ЭХМА – косвенные методы (титрование), когда по изменению физического параметра в ходе реакции находят содержание определяемого компонента.
1. ЭЛЕКТРОГРАВИМЕТРИЯ
Характерной особенностью электрогравиметрии является осаждение определяемого элемента путем электролиза на электроде.
Если электролизу подвергается водный раствор электролита
, то на электродах могут протекать различные процессы в зависимости от химической природы катиона и аниона.
Катодные процессы не зависят от материала катода.
1. Если металл расположен в ряду напряжений до алюминия, включительно, то он никогда не восстанавливается на катоде, вместо этого происходит выделение водорода:
-
в кислой среде: 2Н+ +2е → Н2↑
б) в нейтральной и щелочной среде: 2Н2О +2е → Н2↑ + 2ОН-
2. Если металл в ряду напряжений стоит между алюминием и водородом, то в процессе электролиза наблюдается либо совместное выделение металла и водорода, либо выделение одного из этих веществ, все зависит от величины плотности тока:
a) Men+ + ne → Ме0
б) в кислой среде: 2Н+ +2е → Н2↑
в) в нейтральной и щелочной среде: 2Н2О +2е → Н2↑ + 2ОН-
3. Если металл в ряду напряжений стоит за водородом, то при электролизе на катоде выделяется только металл:
Men+ + ne → Ме0
4. Если в растворе присутствуют несколько катионов металлов, то первым восстанавливается тот, окислительно-восстановительный потенциал которого более положителен.
При рассмотрении анодного процесса необходимо учитывать природу аниона, значение рН-среды и материал анода.
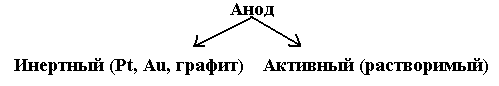
На инертном аноде всегда протекает процесс окисления аниона. При этом окисляться способны только бескислородные анионы
(Cl-, Br-, I-, S2-, Se2- и другие), кроме фторид-иона F-:
2Cl-- – 2e → Cl20↑
Кислородсодержащие анионы (CO32-, SO42-, PO43- и т. д.), а также анион фтора F- никогда не окисляются на инертном аноде, вместо этого протекает процесс окисления воды:
а) в кислой и нейтральной среде: 2Н2О – 4е → О2↑ + 4Н+
б) в щелочной среде: 4ОН- – 4е → О2↑ +2Н2О
В случае растворимого анода происходит растворение самого электрода, например:
Ni0 – 2e → Ni2+
Такой процесс используется для электроочистки металлов – электролитическое рафинирование.
В случае элементов с переменной валентностью процессы окисления или восстановления могут протекать до промежуточных степеней окисления:
Fe2+ – e ↔ Fe3+; Pb2+ – 2e → Pb4+, а затем Pb4+ + 2H2O → PbO2 + 4H+
1.1. Законы электролиза
Количественно процессы электролиза были описаны Майклом Фарадеем в 30-х гг. XIX в.
Первый закон Фарадея
Массы образующихся при электролизе веществ пропорциональны количеству электричества, прошедшего через раствор:
где А – атомная масса элемента;
I – сила тока, А;
t – время электролиза, с;
n – число электронов, участвующих в процессе;
F– число Фарадея 96 500 Кл;
Q – количество электричества, Кл.
Объединенный закон Фарадея
Если через ряд последовательно соединенных ячеек пропустить определенное количество электричества, то на электродах выделяются массы веществ, пропорциональные их эквивалентам.
1.2. Виды поляризации электродов
При прохождении электрического тока потенциал электрода не соответствует значению, вычисленному по уравнению Нернста. Такой электрод называется поляризованным. Таким образом, поляризация – это явление, вызывающее отклонение электродного потенциала от его равновесного значения.
Различают три вида поляризации: химическая, электрохимическая и концентрационная.
-
Химическая поляризация. Этот вид поляризации связан с задержкой процесса восстановления ионов на катоде. -
Электрохимическая поляризация обусловлена тем, что при протекании электролиза на электродах выделяются продукты, которые образуют гальванический элемент, ЭДС которого направлена противоположно ЭДС источника тока. Электрохимическая поляризация не зависит от плотности тока. Уменьшить или устранить ее можно введением в раствор деполяризаторов, разряжающихся раньше определяемых ионов. -
Концентрационная поляризация связана с возникновением дополнительной разности потенциалов в связи с обеднением приэлектродного слоя ионами, по сравнению с глубинными слоями раствора. Концентрационная поляризация, в отличие от электрохимической, зависит от плотности тока:
а) если плотность тока мала – концентрационная поляризация отсутствует
, и скорость диффузии ионов велика и соизмерима со скоростью восстановления;
б) увеличение плотности тока приводит к увеличению скорости восстановления ионов. Приэлектродный слой не успевает пополняться ионами из глубины раствора, при этом возникает разность концентраций, что приводит к возникновению дополнительной разности потенциалов:
где С0 – концентрация ионов в глубине раствора;
С1 – концентрация ионов в приэлектродном слое;
в) при дальнейшем увеличении плотности тока скорость диффузии становится равной скорости восстановления. Концентрация ионов в приэлектродном слое становится равной нулю. С этого момента плотность тока не влияет на величину концентрационной поляризации.
Концентрационная поляризация устраняется путем перемешивания раствора.
1.3. Напряжение разложения
В силу того, что при электролизе существует явление поляризации, для протекания непрерывного процесса электролиза к электродам необходимо прилагать напряжение, превышающее ЭДС поляризации (рис. 1).
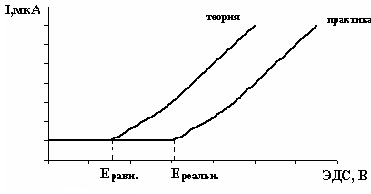
Рис. 1. Изменение силы тока с увеличением напряжения при электролизе
Наименьшая разность потенциалов, которую необходимо приложить к электродам для того, чтобы протекал непрерывный электролиз данного электролита, называется его напряжением разложения.
К примеру, равновесная разность потенциалов, необходимая для выделения кадмия из сернокислого раствора, составляет 1,64 В. Однако для того, чтобы выделить кадмий на катоде, необходимо приложить 2,03В – реальную разницу потенциалов.
1.4. Перенапряжение
Избыточный скачок потенциала, который возникает при замене платинированного электрода на любой другой, называется перенапряжением на этом электроде.
Под перенапряжением также понимают то минимальное напряжение, которое необходимо приложить к электродам, чтобы на данных электродах с заданной плотностью тока протекал непрерывный электролиз.
Перенапряжение (η) представляет собой разницу между значениями напряжения разложения и равновесного потенциала, рассчитанного по уравнению Нернста: