Файл: Химия наука о строении, свойствах веществ, их превращениях и сопровождающих явлениях.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 22.11.2023
Просмотров: 121
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
счет АО в разных энергетических состояниях, имеют одинаковую энергию. Так, Be*(2s11p1), B*(2s12p2), C*(2s12p3) образуют за счет s- и p-орбиталей соответственно две, три и четыре связи, а потому одна из них должна быть прочнее других. Однако опыт показывает, что в BeH2, BCl3, CH4 все связи равноценны. У BeH2 угол связи равен 180°, у BCl3 – 120°, а у CH4 – 109°28'.
Согласно представлению о гибридизации, химические связи образуются смешанными – гибридными орбиталями (ГО), которые представляют собой линейную комбинацию АО данного атома (s- и p-АО Be, B, C), обладают одинаковыми энергией и формой, определенной ориентацией в пространстве (симметрией). Так s- и p-орбитали дают две sp-ГО, расположенные под углом 180° друг относительно друга.
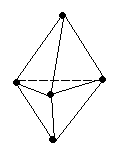
В молекуле CH4 гибридные орбитали из четырех АО углерода (одной s и трех p), называются sp3-орбиталями, они полностью эквивалентны энергетически и пространственно направлены к вершинам тетраэдра.
Таким образом, когда один атом образует несколько связей, а его валентные электроны принадлежат разным орбиталям (s и p; s, p и d), для объяснения геометрии молекул в МВС необходимо привлекать теорию гибридизации атомных орбиталей. Основные положения теории следующие:
Согласно табл. 3.3 гибридные орбитали дают молекулы с углами 180°, 120°, 109°28', 90°. Это правильные геометрические фигуры. Такие молекулы образуются, когда все периферические атомы в многоэлектронной молекуле (или ионе) одинаковы и их число совпадает с числом гибридных орбиталей. Однако, если число гибридных орбиталей больше числа связанных атомов, то часть гибридных орбиталей заселена электронными парами, не участвующими в образовании связи, –
несвязывающими или неподеленными электронными парами.
В качестве примера рассмотрим молекулы NH3 и H2O. Атомы азота и кислорода склонны к sp3-гибридизации. У азота на sp
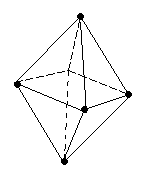
3-ГО, поимо трех связывающих пар электронов, образующих связь с тремя атомами водорода, остается одна несвязывающая пара. Именно она, занимая одну sp3-ГО, искажает угол связи H–N–H до 107,3°. В молекуле H2O таких несвязывающих пар две, и угол H–O–H равен 104,5° (рис. 3.17).
Электроны связывающих и несвязывающих пар по-разному взаимодействуют между собой. Чем сильнее межэлектронное отталкивание, тем больше условная поверхность на сфере, занимаемый электронной парой. Для качественного объяснения экспериментальных фактов обычно считается, что несвязывающие пары занимают больший объем, чем связывающие, а объем связывающих пар тем меньше, чем больше электроотрицательности периферийных атомов (метод Гиллеспи).
12) Метод молекулярных орбиталей.
- Метод молекулярных орбиталей исходит из того, что каждую молекулярную орбиталь представляют в виде алгебраической суммы (линейной комбинации) атомных орбиталей. Например, в молекуле водорода в образовании МО могут участвовать только 1s атомные орбитали двух атомов водорода, которые дают две МО, представляющие собой сумму и разность атомных орбиталей 1s1 и 1s2 – МО± = C11s1 ±C21s2.
Поскольку ядра во взаимодействующих атомах водорода одинаковы, то и вклад атомных орбиталей будет одинаковым, что обеспечивается равенством коэффициентов, с которыми s-орбитали участвуют в линейной комбинации (C1 = C2 = C). Поскольку должно выполняться требование, что сумма квадратов коэффициентов при АО равна 1, то имеем 2C2 = 1, откуда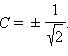 Опуская этот нормировочный множитель, запишем две молекулярные орбитали как сумму и разность АО атомов водорода:
Опуская этот нормировочный множитель, запишем две молекулярные орбитали как сумму и разность АО атомов водорода:
Электронная плотность этих двух состояний пропорциональна |MO±|2. Поскольку в молекуле водорода взаимодействие возможно только по оси молекулы, то каждая из MO± может быть переобозначена как σсв = 1s1 + 1s2 и σ* = 1s1 – 1s2 и названа соответственно связывающей (σсв) и разрыхляющей (σ*) молекулярными орбиталями (рис. 3.7).
Из рис. 3.7 видно, что электронная плотность посередине между ядрами для σсв значительна, а для σ* равна нулю. Отрицательно заряженное электронное облако, сконцентрированное в межъядерном пространстве, притягивает положительно заряженные ядра и соответствует связывающей молекулярной орбитали σсв. А МО с нулевой плотностью в межъядерном пространстве соответствует разрыхляющей орбитали σ*. Состояния σсв и σ* отвечают разным уровням энергии, причем молекулярная орбиталь σсв имеет более низкую энергию по сравнению с исходными АО двух невзаимодействующих атомов водорода 1s1 и 1s2 (рис. 3.8).
Переход двух электронов на МО σсв способствует понижению энергии системы; этот энергетический выигрыш равен энергии связи между атомами в молекуле водорода H–H. Даже удаление одного электрона с МО (σсв)2 c образованием (σсв)1 в молекулярном ионе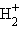 оставляет эту систему более устойчивой, чем отдельно существующие атом H и ион H+.
оставляет эту систему более устойчивой, чем отдельно существующие атом H и ион H+.
Рис. 3.9 иллюстрирует изменение энергии МО σсв и σ* в зависимости от межатомного расстояния r12. При большом расстоянии r12 их энергия будет мало отличаться от энергий АО 1s1 и 1s2. При некотором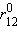 энергия σсв достигнет минимума и будет соответствовать энергии связи Eсв молекулы H–H. При дальнейшем сближении ядер энергии σ
энергия σсв достигнет минимума и будет соответствовать энергии связи Eсв молекулы H–H. При дальнейшем сближении ядер энергии σ
св и σ* начинают повышаться, поскольку силы отталкивания начинают преобладать над силами притяжения. В молекуле ядра колеблются вблизи равновесного расстояния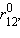 соответствующего минимуму энергии
соответствующего минимуму энергии 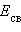 .
.
Приведенная на рис. 3.9 энергетическая диаграмма МО справедлива для двухъядерных образований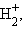
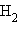 , HHe,
, HHe, 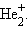 Распределение валентных электронов по МО записывают электронными формулами:
Распределение валентных электронов по МО записывают электронными формулами: 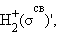
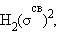
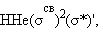
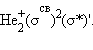
Заселение электронами связывающей МО σсв стабилизирует систему, а заселение разрыхляющих – дестабилизирует ее (табл. 3.1).
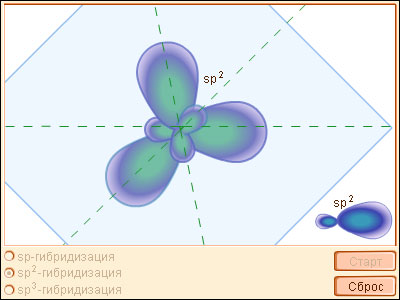 |
| Модель 3.4. Гибридизация орбиталей |
Согласно представлению о гибридизации, химические связи образуются смешанными – гибридными орбиталями (ГО), которые представляют собой линейную комбинацию АО данного атома (s- и p-АО Be, B, C), обладают одинаковыми энергией и формой, определенной ориентацией в пространстве (симметрией). Так s- и p-орбитали дают две sp-ГО, расположенные под углом 180° друг относительно друга.
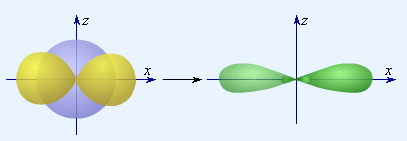 |
| Рисунок 3.16 s-орбиталь + p-орбиталь и две sp-ГО |
В молекуле CH4 гибридные орбитали из четырех АО углерода (одной s и трех p), называются sp3-орбиталями, они полностью эквивалентны энергетически и пространственно направлены к вершинам тетраэдра.
Таким образом, когда один атом образует несколько связей, а его валентные электроны принадлежат разным орбиталям (s и p; s, p и d), для объяснения геометрии молекул в МВС необходимо привлекать теорию гибридизации атомных орбиталей. Основные положения теории следующие:
-
Введение гибридных орбиталей служит для описания направленных локализованных связей. Гибридные орбитали обеспечивают максимальное перекрывание АО в направлении локализованных σ-связей.
-
Число гибридных орбиталей равно числу АО, участвующих в гибридизации.
-
Гибридизуются близкие по энергии валентные АО независимо от того, заполнены они в атоме полностью, наполовину или пусты.
-
В гибридизации участвуют АО, имеющие общие признаки симметрии.
Согласно табл. 3.3 гибридные орбитали дают молекулы с углами 180°, 120°, 109°28', 90°. Это правильные геометрические фигуры. Такие молекулы образуются, когда все периферические атомы в многоэлектронной молекуле (или ионе) одинаковы и их число совпадает с числом гибридных орбиталей. Однако, если число гибридных орбиталей больше числа связанных атомов, то часть гибридных орбиталей заселена электронными парами, не участвующими в образовании связи, –
несвязывающими или неподеленными электронными парами.
| ||||||||||||||||||||||||||||||
| Таблица 3.3 Гибридные орбитали и геометрия молекул |
В качестве примера рассмотрим молекулы NH3 и H2O. Атомы азота и кислорода склонны к sp3-гибридизации. У азота на sp
3-ГО, поимо трех связывающих пар электронов, образующих связь с тремя атомами водорода, остается одна несвязывающая пара. Именно она, занимая одну sp3-ГО, искажает угол связи H–N–H до 107,3°. В молекуле H2O таких несвязывающих пар две, и угол H–O–H равен 104,5° (рис. 3.17).
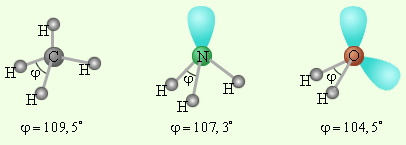 |
| Рисунок 3.17 Несвязывающие электронные пары и углы связи в молекулах NH3 и H2O в сравнении с молекулой CH4 |
Электроны связывающих и несвязывающих пар по-разному взаимодействуют между собой. Чем сильнее межэлектронное отталкивание, тем больше условная поверхность на сфере, занимаемый электронной парой. Для качественного объяснения экспериментальных фактов обычно считается, что несвязывающие пары занимают больший объем, чем связывающие, а объем связывающих пар тем меньше, чем больше электроотрицательности периферийных атомов (метод Гиллеспи).
12) Метод молекулярных орбиталей.
- Метод молекулярных орбиталей исходит из того, что каждую молекулярную орбиталь представляют в виде алгебраической суммы (линейной комбинации) атомных орбиталей. Например, в молекуле водорода в образовании МО могут участвовать только 1s атомные орбитали двух атомов водорода, которые дают две МО, представляющие собой сумму и разность атомных орбиталей 1s1 и 1s2 – МО± = C11s1 ±C21s2.
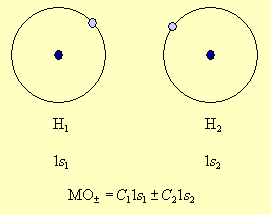 |
| Рисунок 3.6 |
Поскольку ядра во взаимодействующих атомах водорода одинаковы, то и вклад атомных орбиталей будет одинаковым, что обеспечивается равенством коэффициентов, с которыми s-орбитали участвуют в линейной комбинации (C1 = C2 = C). Поскольку должно выполняться требование, что сумма квадратов коэффициентов при АО равна 1, то имеем 2C2 = 1, откуда
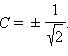 Опуская этот нормировочный множитель, запишем две молекулярные орбитали как сумму и разность АО атомов водорода:
Опуская этот нормировочный множитель, запишем две молекулярные орбитали как сумму и разность АО атомов водорода: | |
| |
Электронная плотность этих двух состояний пропорциональна |MO±|2. Поскольку в молекуле водорода взаимодействие возможно только по оси молекулы, то каждая из MO± может быть переобозначена как σсв = 1s1 + 1s2 и σ* = 1s1 – 1s2 и названа соответственно связывающей (σсв) и разрыхляющей (σ*) молекулярными орбиталями (рис. 3.7).
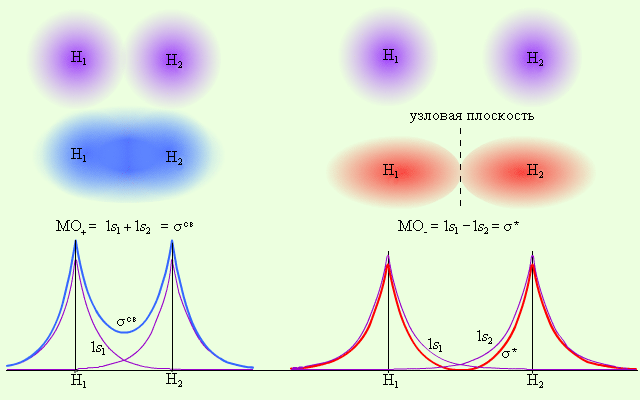 |
| Рисунок 3.7 Распределение электронной плотности в молекуле H2 |
Из рис. 3.7 видно, что электронная плотность посередине между ядрами для σсв значительна, а для σ* равна нулю. Отрицательно заряженное электронное облако, сконцентрированное в межъядерном пространстве, притягивает положительно заряженные ядра и соответствует связывающей молекулярной орбитали σсв. А МО с нулевой плотностью в межъядерном пространстве соответствует разрыхляющей орбитали σ*. Состояния σсв и σ* отвечают разным уровням энергии, причем молекулярная орбиталь σсв имеет более низкую энергию по сравнению с исходными АО двух невзаимодействующих атомов водорода 1s1 и 1s2 (рис. 3.8).
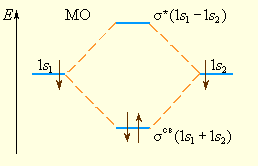 |
| Рисунок 3.8 Энергетическая диаграмма атомных и молекулярных уровней водорода |
Переход двух электронов на МО σсв способствует понижению энергии системы; этот энергетический выигрыш равен энергии связи между атомами в молекуле водорода H–H. Даже удаление одного электрона с МО (σсв)2 c образованием (σсв)1 в молекулярном ионе
Рис. 3.9 иллюстрирует изменение энергии МО σсв и σ* в зависимости от межатомного расстояния r12. При большом расстоянии r12 их энергия будет мало отличаться от энергий АО 1s1 и 1s2. При некотором
св и σ* начинают повышаться, поскольку силы отталкивания начинают преобладать над силами притяжения. В молекуле ядра колеблются вблизи равновесного расстояния
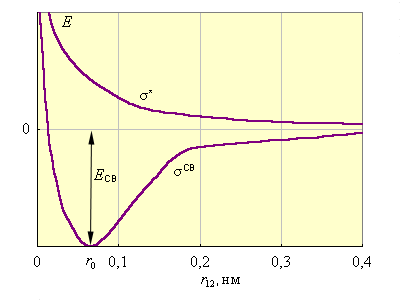 |
| Рисунок 3.9 Энергии МО в H2 в зависимости от межъядерного расстояния. |
Приведенная на рис. 3.9 энергетическая диаграмма МО справедлива для двухъядерных образований
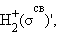
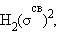
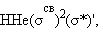
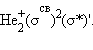
Заселение электронами связывающей МО σсв стабилизирует систему, а заселение разрыхляющих – дестабилизирует ее (табл. 3.1).
| |||||||||||||||||||||||||||||||||||
| Таблица 3.1 Энергия, длина и порядок связи в молекулах элементов 1 периода | |||||||||||||||||||||||||||||||||||