ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.11.2023
Просмотров: 48
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
| T1, K | а | в | с | d | е | T2, K |
| 1033 | 45 | 95 | 10 | 45 | 75 | 983 |
| Системы | NA | 0 | 13,3 | 22,2 | 35,8 | 37,6 | 40 | 47 | 50,6 | 53 | 61,6 | 66,8 | 74,6 | 80,6 | 81,6 | 84,8 | 100 |
| А—FeС13 B—NaCl | Ткр | 1073 | 1052 | 1033 | 989 | 975 | 983 | 999 | 1003 | 983 | 753 | 680 | 641 | 622 | 642 | 697 | 859 |
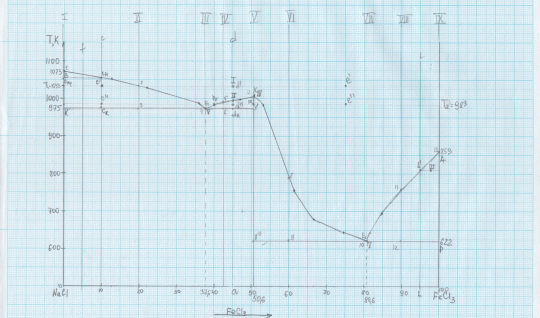
Задание 2
Обозначены фигуративные точки:
I - жидкий расплав, содержащий, 45 % вещества FeCl3 при температуре 1033 К. Найдем на оси абсцисс точку, соответствующую составу 45 % FeCl3 – это точка а. На оси ординат отмечаем температуру T1 = 1033 К. На пересечении линий получаем точку I, которая расположена в области выше линии ликвидуса, т.е. в области жидкого расплава.
II — расплав, содержащий, 45 % вещества FeCl3, находящийся в равновесии с кристаллами химического соединения. Аналогичным образом найдем на оси абсцисс точку, соответствующую составу 45 % FeCl3 – это точка К. Восстановим перпендикуляр до пересечения с линией ликвидуса и получим точку II.
III — систему, состоящую из твердого вещества FeCl3, находящегося в равновесии с расплавом
, содержащим 95 % вещества FeCl3. Найдем на оси абсцисс точку, соответствующую составу 95 % FeCl3 – это точка L. Восстановим перпендикуляр до пересечения с линией ликвидуса и получим точку L’. Любой сплав, при температуре, соответствующей L’ с содержанием компонента FeCl3 от 100 до 95 % можно отметить точкой III.
IV — равновесие фаз одинакового состава. Точка соответствует началу кристаллизации химического соединения Х. В начале кристаллизации в равновесии находятся кристаллы этого химического соединения и расплава одного химического состава.
V — равновесие трех фаз. Равновесие трех фаз имеет место в точках эвтектики E1 и E2. В этих точках система состоит из расплава и двух кристаллических фаз одновременно.
Задание 3. Определите состав устойчивого химического соединения.
Для этого между двух точек с наименьшей температурой плавления Е1 и Е2 найдем точку с наибольшей температурой плавления Х. Опустим перпендикуляр на ось концентраций и получим состав: 50,6 % FeCl3 и 49,4 % NaCl.
Обозначим формулу интерметаллического соединения через AxBy. Нетрудно показать, что x:y = N(A):N(B) =
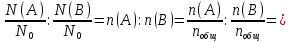 NA:NB, где N(A) и N(B) – число молекул А и В соответственно,
NA:NB, где N(A) и N(B) – число молекул А и В соответственно,  - число Авогадро,
- число Авогадро,  и
и  - количества веществ А и В соответственно,
- количества веществ А и В соответственно,  =
= – общее число моль А и В в системе. Таким образом, если состав смеси выражен в молярных %, то x:y= NA:NB=50,6 : 49,4, соответственно очень сложно расчитать точное стехиометрическое соотношение. Формула интерметаллического соединения может быть записана как AxBy(в общем виде), или (FeCl3)x*(NaCl)y.
– общее число моль А и В в системе. Таким образом, если состав смеси выражен в молярных %, то x:y= NA:NB=50,6 : 49,4, соответственно очень сложно расчитать точное стехиометрическое соотношение. Формула интерметаллического соединения может быть записана как AxBy(в общем виде), или (FeCl3)x*(NaCl)y. Задание 4. Определите качественный и количественный составы эвтектик.
Рассмотрим эвтектику, соответствующую точке Е1.
Кристаллическими фазами, входящими в состав этой эвтектики являются расположенные справа и слева от нее чистые компоненты – кристаллический NaCl (0 % FeCl3) и химическое соединение X (FeCl3)x*(NaCl)y (50.6 % FeCl3).
Количество кристаллических компонентов после окончания кристаллизации можно найти по правилу рычага.
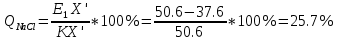

Рассмотрим эвтектику, соответствующую точке Е2.
Кристаллическими фазами, входящими в состав этой эвтектики являются расположенные справа и слева от нее чистые компоненты – химическое соединение Х (FeCl3)x*(NaCl)y (50.6 % FeCl3) и кристаллы FeCl3 (100 % FeCl3).
Количество кристаллических компонентов после окончания кристаллизации можно найти по правилу рычага.

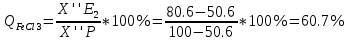
Таблица 4.1. Качественный и количественный состав эвтектик.
| Описание эвтектик | Качественный состав | Количественный состав |
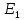 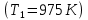 | NaCl - (FeCl3)x*(NaCl)y | 25.7 % NaCl и 74,3 % (FeCl3)x*(NaCl)y |
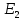 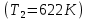 | (FeCl3)x*(NaCl)y - FeCl3 | 39,3 % (FeCl3)x*(NaCl)y и 60,7 % FeCl3 |
Задание 5. Вычертите все типы кривых охлаждения, возможные для данной системы, укажите, каким составам на диаграмме плавкости эти кривые соответствуют.
I – 100 % NaCl
До т.1 – расплав. Т. 1-1’ кристаллизация NaCl. Ниже т. 1’ – охлаждение NaCl.
II – 80% NaCl, 20 % FeCl3
До т.2 – расплав. В т.2 начинается кристаллизация NaCl, она идет до т.3. Т 3-3’ – эвтектическая реакция – из оставшейся жидкости одновременно кристаллизуются NaCl и (FeCl3)x*(NaCl)y. Ниже т.3’ охлаждения сплава, состоящего из NaCl и эвтектики.
III – 62.4 % NaCl, 37.6 % FeCl3
До т.4 – расплав. Т. 4-4’ – эвтектическая реакция – из жидкости одновременно кристаллизуются NaCl и (FeCl3)x*(NaCl)y. Ниже т.4’ охлаждения сплава, состоящего из эвтектики.
IV – 42.5 % FeCl3, 57.5 % NaCl
До т.5 – расплав. В т.5 начало кристаллизации химического соединения (FeCl3)x*(NaCl)y. до точки 6. Т 6-6’ – эвтектическая реакция – из оставшейся жидкости одновременно кристаллизуются NaCl и (FeCl3)x*(NaCl)y.. Ниже т.6’ охлаждения сплава, состоящего из (FeCl3)x*(NaCl)y. и эвтектики.
V – 50.6 % FeCl3, 49.4 % NaCl
До т.7 – расплав. Т 7-7’ кристаллизация химического соединения (FeCl3)x*(NaCl)y. Ниже т.7’ – охлаждение кристаллизовавшегося химического соединения (FeCl3)x*(NaCl)y.
VI – 60 % FeCl3, 40 % NaCl
До т.8 – расплав. В т.8 начало кристаллизации химического соединения (FeCl3)x*(NaCl)y до точки 9. Т 9-9’ – эвтектическая реакция – из оставшейся жидкости одновременно кристаллизуются (FeCl3)x*(NaCl)y и FeCl3 . Ниже т.9’ охлаждения сплава, состоящего из (FeCl3)x*(NaCl)y и эвтектики.
VII – 80.6 % FeCl3, 19.4 % NaCl
До т.10 – расплав. Т. 10-10’ – эвтектическая реакция – из жидкости одновременно кристаллизуются (FeCl3)x*(NaCl)y и FeCl3. Ниже т.10’ охлаждения сплава, состоящего из эвтектики.
VIII – 10 % NaCl, 90 % FeCl3
До т.11 – расплав. В т.11 начинается кристаллизация FeCl3, она идет до т.12. Т 12-12’ – эвтектическая реакция – из оставшейся жидкости одновременно кристаллизуются (FeCl3)x*(NaCl)y и FeCl3. Ниже т.12’ охлаждения сплава, состоящего из FeCl3 и эвтектики.
IX – 100 % FeCl3.
До т.13 – расплав. Т. 13-13’ кристаллизация FeCl3.. Ниже т. 13’ – охлаждение FeCl3.

Задание 6. В каком фазовом состоянии находятся системы, содержащие 10, 45, 75 % вещества FeCl3 при температуре 1033 К? Что произойдет с этими системами, если их охладить до температуры 983 К?
Система, содержащая 10 % вещества FeCl3
Система содержит 10 % FeCl3. При температуре Т1=1033 К состояние системы характеризует точка с’. Система состоит из расплава и кристаллов NaCl. При охлаждении системы до температуры Т2=983 К состояние системы характеризует точка с’’. Система состоит из расплава и кристаллов NaCl.
Система, содержащая 45 % вещества FeCl3
Система содержит 45 % FeCl3. При температуре Т1=1033 К состояние системы характеризует точка d’. Система состоит из расплава. При охлаждении системы до температуры Т2=983 К состояние системы характеризует точка d’’. Система состоит из расплава и кристаллов химического соединения (FeCl3
)x*(NaCl)y.
Система, содержащая 75 % вещества FeCl3
Система содержит 75 % FeCl3. При температуре Т1=1033 К состояние системы характеризует точка e’. Система состоит из расплава. При охлаждении системы до температуры Т2=983 К состояние системы характеризует точка e’’. Система состоит из расплава.
Таблица 6.1. Фазовое состояние системы с различным содержанием компонента А.
| Содержание вещества FeCl3 в системе, % мол. | Фазовое состояние системы при температуре 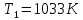 | Фазовое состояние системы при температуре 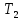 = 983 К = 983 К |
| c =10 | расплав + NaCl | расплав + NaCl |
| d = 45 | расплав | расплав + (FeCl3)x*(NaCl)y |
| e = 75 | расплав | расплав |
Задание 7. Определите число фаз и число условных термодинамических степеней свободы системы при эвтектической температуре и молярной доле компонента А 95 и 5 %.
Система, содержащая5 % мол. вещества А соответствует линии f.
Эвтектическая температура данной системы 975 К. При эвтектической температуре система состоит из 3 фаз: расплав, кристаллы химического соединения (FeCl3)x*(NaCl)y и кристаллы NaCl.
Рассчитаем число условных термодинамических степеней свободы системы:
C = K + 1 – Ф,
где С – число степеней свободы системы;
К – число компонентов, образующих систему;
1 – число внешних факторов (внешним фактором считаем только температуру, так как давление за исключением очень высокого мало влияет на фазовое равновесие сплавов в твердом и жидком состояниях);
Ф – число фаз, находящихся в равновесии.
Таким образом:
К – два компонента NaCl и FeCl3
Ф – три фазы.
C = 2 + 1 – 3=0
система нонвариантная, процесс идет при постоянной температуре.
Система, содержащая 95 % мол. вещества А соответствует линии L.
Эвтектическая температура данной системы 622 К. При эвтектической температуре система состоит из 3 фаз: расплав, кристаллы химического соединения (FeCl3)x*(NaCl)y и кристаллы FeCl