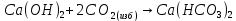Файл: Отчет по лабораторной работе Классы неорганических соединений по дисциплине химия.docx
Добавлен: 23.11.2023
Просмотров: 27
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего образования
ИРКУТСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Институт/Факультет – Заочно-Вечернего обучения
Кафедра – Электроэнергия и электротехника.
Отчет по лабораторной работе: Классы неорганических соединений.
по дисциплине: химия
Выполнил студент гр. ЭСбз-22-1
Подпись С.В.Писанко
Дата:
Принял: доцент кафедры химии
Подпись Л.А. Бегунова
Дата:
2023 г.
Цель работы: исследовать методы получения основных классов неорганических соединений.
Часть 1 Оксиды.
Опыт 1.1.
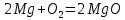
При возгорании Mg вспыхивает ярко – белым пламенем. MgO – порошок белого цвета.
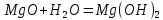
При добавлении ФФ раствор окрасился в малиновый цвет, что говорит о щелочной среде.
Являясь основным оксидом, MgO взаимодействует с
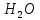 , образуя основание
, образуя основание 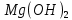 .
. При этом быстрее реакция проходит с водяным паром.
Опыт 1.2.
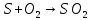
При возгорании S горит синим пламенем.
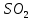 – бесцветный газ с резким запахом.
– бесцветный газ с резким запахом.При поднесении влажной лакмусовой бумажки к горящей сере, она становится розовой, что говорит о кислотной среде.
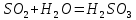
Сернистая кислота неустойчива, реакция обратима.
Часть 2. Основания.
Опыт 2.1.
NaOH + ФФ - раствор малинового цвета
NaOH + метилоранж – раствор желтого цвета
NaOH + лакмус – раствор синего цвета
Опыт 2.2.
NaOH + ФФ - раствор малинового цвета
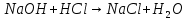
раствор стал бесцветным т.к. щелочная среда нейтрализована.
Опыт 2.3.
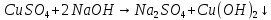
образование в ходе реакции голубого коллоидного осадка.
Опыт 2.4.
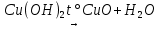
появление при нагревании черного осадка.
Опыт 2.5.
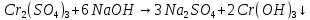
появление в ходе реакции осадка серо-зеленого цвета.
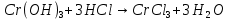
растворение осадка и образование раствора сине-зеленого цвета.
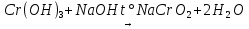
растворение осадка и образование раствора зеленого цвета.
Часть 3 Кислоты
Опыт 3.1.
HCl+ФФ – раствор бесцветный
HCl+ метилоранж – раствор розового цвета
HCl+ лакмус – раствор красного цвета
Опыт 3.2.
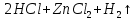
наблюдается выделение газа
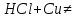
реакция не идет т.к. медь в электрохимическом ряду напряжения расположена после водорода.
Опыт 3.3.
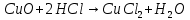
при реакции, образовавшийся раствор имеет сине-голубой цвет
Опыт 3.4.
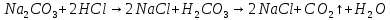
угольная кислота не устойчивая, существует лишь в растворах.
Часть 4 Соли.
Опыт 4.1.
Zn – металл серого цвета.
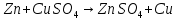
появление темного налета Cu.
Опыт 4.2.
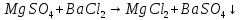
появление осадка белого цвета.
Опыт 4.3.
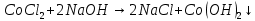
появление розового осадка.
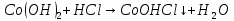
появление осадка синего цвета.
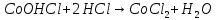
растворение осадка.
Опыт 4.4.
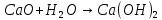
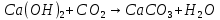
появление помутневшего раствора