Файл: После проработки главы учебника и усвоения теоретического материала.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.11.2023
Просмотров: 26
Скачиваний: 3
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
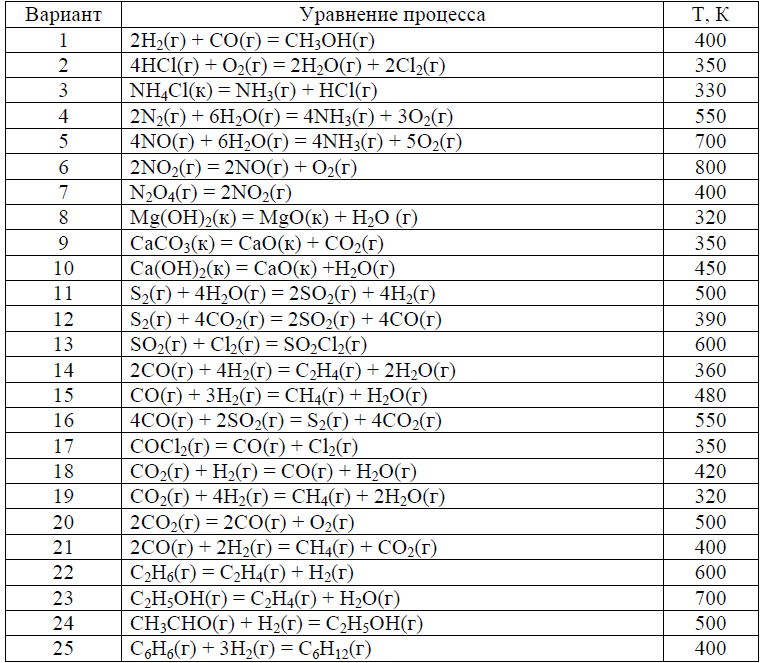
Варианты контрольных заданий приводятся в табл. 1. Каждый студент выполняет свой вариант задания. Вариант задания для каждого студента- это две последние цифры его зачётки (в случае, когда две последние цифры больше 25, то они складываются).
Основной составляющей учебного процесса для студента-заочника является работа с литературой. Изучать курс следует по разделам в соответствии с программой. Лучшему усвоению и запоминанию материала способствует составление конспекта.
После проработки главы учебника и усвоения теоретического материала
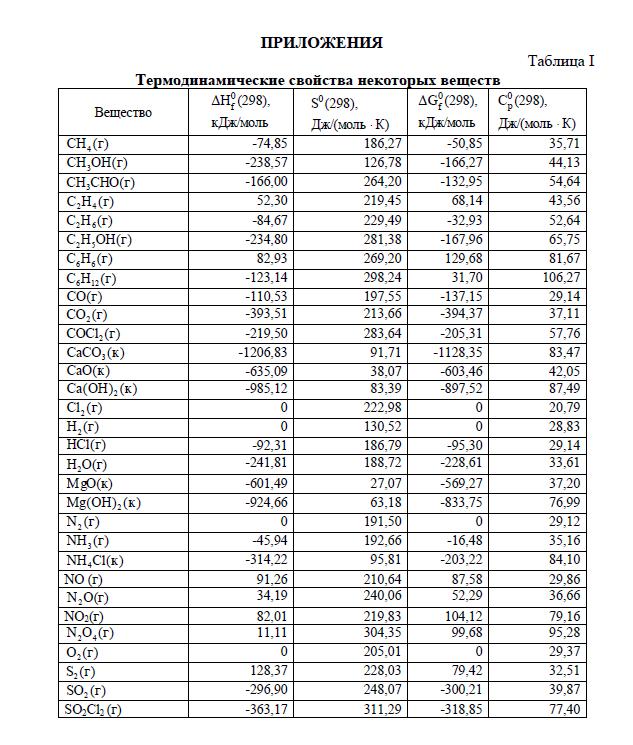
студент приступает к решению контрольных задач. Текст задач переписывается полностью. Решения задач должны быть обоснованными, с использованием основных теоретических положений, необходимых математических формул. Следует приводить весь ход решений и математических преобразований, для численных величин указывать единицы измерения, графики чертить на миллиметровой бумаге. Необходимые для решения задач справочные данные можно найти в таблицах приложений или справочной литературе.
Контрольные работы должны быть аккуратно оформлены в отдельной тетради, текст должен быть четким и ясным.
Титульный лист должен содержать сведения о студенте с обязательным
указанием направления подготовки и шифра (номера студенческого билета), названия дисциплины. Фото контрольной работы прикрепляется в ЦДО.
Задания на контрольную работу
Процесс протекает в соответствии с уравнением реакции при температуре Т
(табл. 1).
1.1. Рассчитать Н0, S0, G0 процесса при 298 К (прил., табл. 1, рис.1).
1.2. Дать термодинамическую характеристику процесса, исходя из величин изменений термодинамических функций при стандартных условиях.
1.3. Рассчитать НТ, SТ, GТ процесса при температуре Т и оценить ее влия-
ние на направление протекания процесса. Расчеты производить на основании
справочных данных о термодинамических свойствах веществ по предложенному алгоритму (Приложение,Рис.1).
Таблица 1.
Пример 1
Процесс протекает в соответствии с уравнением:
С2Н5ОН(г) + 3О2(г) = 2СО2(г) + 3Н2О(г) при температуре 800 К.
1.1. Рассчитайте величины Н0, S0, G0 при 298 К и дайте термодинамическую характеристику процесса при стандартных условиях.
1.2. Рассчитайте величины Нт, Sт, Gт при температуре 800 К и оцените влияние повышения температуры на направление протекания реакции.
Р е ш е н и е
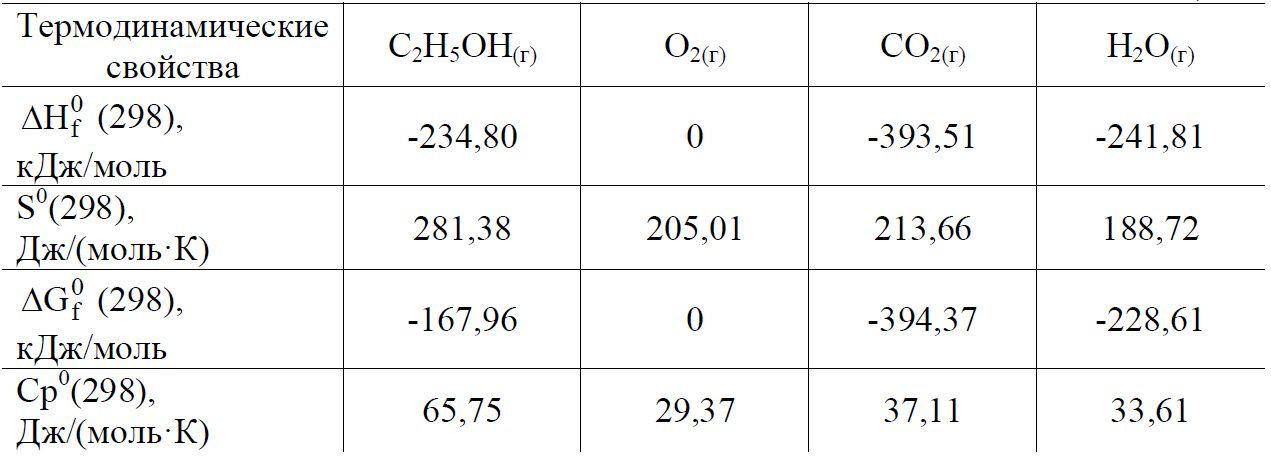
Для расчета Н0, S0, G0 при 298 К выпишем термодинамические свойства веществ – участников реакции табл.2 (приложение).
Таблица 2
-
При стандартных условиях изменение энтальпии химической реакции H , изменение энтропии S и изменение энергии Гиббса химической реакции G рассчитаем по предложенным формулам (Рис.1), используя следствие из закона Гесса и данные табл. (Приложение)
С2Н5ОН(г) + 3О2(г) = 2СО2(г) + 3Н2О(г) при температуре 800 К.
1) H = i 0 Hi (кон.) - i 0 Hi (нач.) = (2H0(СО2) + 3H0(Н2О)) -
-(H(С2Н5ОН) + 3H(О2)) = (2·(-393,51) + 3(-241,81)) – ((-234,80) + 3·0) =
= -1277,62 кДж;
S = (2S(СО2) + 3S(Н2О)) – (S(С2Н5ОН) + 3S(О2)) = (2·213,66 +
+ 3·188,72) – (281,38 + 3·205,01) = 96,95 Дж/К;
Gr = (2G(СО2) + 3G(Н2О)) – (G(С2Н5ОН) + 3G(О2)) =
= (2·(-394,37) + 3(-228,61)) – ((-167,96) + 3·0) = -1306,61 кДж;
G можно рассчитать вторым способом по уравнению Гиббса:
Gr = Hr - Т Sr = -127,62 – 298(-0,09695) = -1306,51кДж.
Величины G(298), рассчитанные двумя способами, практически совпа-
дают. Так как H < 0, процесс протекает с выделением теплоты, т. е. является экзотермическим; S > 0, процесс протекает с увеличением беспорядка в системе (неупорядоченность системы увеличивается); Gr < 0, поэтому при 298 К процесс протекает самопроизвольно в прямом направлении.
1.2 Для расчета термодинамических функций при температуре 800 К
воспользуемся формулой:

S2+ 4CO2 = 2SO2 +4CO (390)
1) H = i 0 Hi (кон.) - i 0 Hi (нач.) = (2H0(SO2) + 4H0(CО)) -
-(4H(CO2) + H(S2)) =
(2·(-296,90) + 4(-110,53)) – (4(-393,51) + 128,37)
= 409,75 кДж;
S = (2S(SO2) + 4S(CO)) – 4 (S(CO2) + S(S2)) =
(2·248,07 + 4·197,55) – (4* 213,66 + 228.03)
= 204,85 Дж/К;
Gr = (2G(SO2) + 4G(CO)) –4 (G(CO2) + G(S2)) =
= (2·(-300,21) + 4(-137.15)) – 4((-394.37) + 79,42) =349,04 кДж;
Gr = Hr - Т Sr = 409,75 – 298*0,20485= 348,7047 кДж
Ht = 409,75 + 563,96 = 973 кДж
St = 0,20485 + 1,446 = 1,65085 кДж
Gt = 973 – 390 * 1,65085 = 329,1685 кДж