Файл: Отчет Лабораторная работа 2 По дисциплине Химия, часть ii.docx
Добавлен: 29.11.2023
Просмотров: 381
Скачиваний: 23
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ

МИНИСТЕРСТВО НАУКИ ВЫСШЕГО ОБРАЗОВАНИЯ
РОССИЙСКОЙ ФЕДЕРАЦИИ
федеральное государственное бюджетное образовательное учреждение
высшего образования
«САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ»
Кафедра физической химии
Отчет
Лабораторная работа №2
По дисциплине Химия, часть II
(наименование учебной дисциплины согласно учебному плану)
Тема работы: Определение константы нестойкости тиоцианата (роданида) железа фотометрическим методом
Выполнили: студенты гр. НБШ-21 Когут В.В.
(шифр группы) (подпись) (Ф.И.О.)
Оценка:
Дата:
Проверил: доцент Сергеев В.В.
(должность) (подпись) (Ф.И.О.)
Санкт-Петербург
2023
Краткое теоретическое обоснование:
В растворах комплексных соединений существует система динамических равновесий, т. е. комплексные соединения подвержены в значительной степени электролитической диссоциации. Ионы или молекулы, находящиеся во внешней сфере, связаны в комплексном соединении гораздо слабее, чем ионы или молекулы, находящиеся во внутренней сфере. Такая различная прочность связи обусловливает характер диссоциации комплексных соединений. Диссоциация комплексных соединений протекает по стадиям. На первой стадии комплексное соединение диссоциирует как сильный электролит, то есть практически полностью. Далее, комплексный ион диссоциирует как слабый электролит по ступеням, т. е. лиганды отделяются от комплексообразователя постепенно.
Диссоциация комплекса идет лишь в незначительной степени и может быть охарактеризована величиной общей константы ионизации данного комплекса, которая определяется как произведение констант диссоциации по отдельным ступеням.
Чем больше величина этой константы, тем сильнее комплекс диссоциирует, тем менее он устойчив. Эта константа называется
константой нестойкости. Обратная величина константы нестойкости называется константой устойчивости.
Усилить диссоциацию и даже полностью разрушить комплексный ион можно тремя способами:
1) разбавлением и нагреванием раствора, содержащего этот ион;
2) добавлением реагентов, образующих с одним из компонентов комплексного иона малорастворимые или еще менее диссоциирующие молекулы или ионы;
3) применением окислителей или восстановителей.
Константу нестойкости можно установить экспериментально, используя фотометрический метод - Метод анализа, основанный на переведении определяемого компонента в поглощающее свет соединение с последующим определением количества этого компонента путем измерения светопоглощения раствора полученного соединения. Различают фотометрический колориметрический метод анализа (субъективный), используемый в лабораторной работе, и метод анализа с применением фотоэлементов (объективный).
Сущность фотометрического анализа заключается в следующем: определяют уменьшение интенсивности потока монохроматического света после прохождения его через определенной толщины слой окрашенного раствора и, учтя законы светопоглощения, делают вывод о концентрации растворенного вещества.
Основной закон светопоглощения Бугера-Ламберта-Бера определяет зависимость между поглощением излучения раствором и концентрацией в нем поглощаемого вещества:
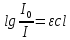
где I0 и I – начальная и конечная интенсивность света,
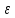 - коэффициент поглощения, с - концентрация раствора, l - толщина слоя раствора, поглощающего свет.
- коэффициент поглощения, с - концентрация раствора, l - толщина слоя раствора, поглощающего свет.Величину
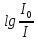 обозначают символом D и называют оптической плотностью.
обозначают символом D и называют оптической плотностью.Цель работы:
Определить констант нестойкости и энергии Гиббса тиоцианатного комплекса железа (III).
Ход эксперимента:
Оборудование и реактивы: фотоколориметр; мерная колба объемом 200 мл – 1 шт.; мерные колбы объемом 50 мл – 8 шт.; пипетки градуированные объемом 10 мл – 2 шт.; пипетка мерная объемом 5 мл – 1 шт.; пипетка мерная объемом 1 мл – 1 шт.; маркированные химические стаканы объемом 100 мл – 3 шт.; химический толстостенный стакан объемом 75 мл – 1 шт.; шприц – 1 шт.; стандартный раствор соли железа – 2 г/моль; азотная кислота – раствор, разбавленный 1:1; роданид калия – 1 М раствор.
Выполнение эксперимента:
В ходе лабораторной работы в маркированный химический стакан отобрана порция стандартного раствора соли железа объемом около 10 мл. Далее в мерный стакан пипеткой отобрано 5 мл стандартного раствора, уровень жидкости дистиллированной водой доведен до метки, раствор тщательно перемешан. В результате получен рабочий раствор соли железа объемом 100 мл.
В мерную колбу мерной пипеткой отобрано 5 мл рабочего раствора. При помощи шприца добавлен 1 мл азотной кислоты. Градуированной пипеткой отобрано 2 мл раствора роданида калия. Данные действия повторены для семи других колб с шагом изменения объема роданида калия в 1 мл. После этого уровень жидкости во всех колбах дистиллированной водой доведен до уровня метки. Растворы тщательно перемешаны. В результате получено семь окрашенных растворов. После этого приготовлен в аналогии с предыдущими растворами раствор сравнения – при этом он не содержит рабочего раствора и имеет прозрачный цвет.
В первую кювету фотоколориметра помещен раствор сравнения, во вторую кювету – первый приготовленный исследуемый раствор. Обе кюветы помещены в фотоколориметр, измерена оптическая плотность раствора при длине волны в 480 нм. После этого кювета с исследуемым раствором извлечена, дважды промыта следующим раствором, залита им и помещена в калориметр. Все действия повторены для оставшихся колб, записаны значения оптических плотностей.
Экспериментальные данные:
Таблица 1 – Содержание протокола лабораторной работы
| Концентрация стандартного раствора соли железа CFe, г/л: | 2 |
| Объем стандартного раствора, взятый для приготовления рабочего раствора Vст, мл: | 5 |
| Объем приготовленного рабочего раствора соли железа Vраб, мл: | 200 |
| Объем рабочего раствора, взятый для выполнения опыта в колбах на 50 мл VFe, мл: | 5 |
| Концентрация раствора роданида калия CKCNS, моль/л: | 1 |
| Толщина кюветы l, см: | 1 |
| Длина волны λ, нм: | 480 |
Таблица 2 – Зависимость оптической плотности от количества роданида калия
| № | VFe, мл | V(HNO3), мл | VKSCN, мл | D |
| 1 | 5 | 1 | 2 | 0,541 |
| 2 | 5 | 1 | 3 | 0,594 |
| 3 | 5 | 1 | 4 | 0,645 |
| 4 | 5 | 1 | 5 | 0,662 |
| 5 | 5 | 1 | 6 | 0,682 |
| 6 | 5 | 1 | 7 | 0,718 |
| 7 | 5 | 1 | 8 | 0,779 |
| 8 | 0 | 1 | 4 | p-p сравнения |
Обработка экспериментальных данных
Основные расчетные формулы:
1. Содержание роданида калия в конечном растворе, моль/л:
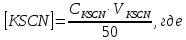
CKSCN – концентрация раствора роданида калия, моль/л;
VKSCN- объем роданида калия, взятый для приготовления рабочего раствора, мл;
50 – объем исследуемых растворов, мл.
2. Содержание железа в колбах на 50 мл, моль/л:
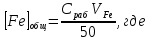
Сраб – концентрация рабочего раствора соли железа, моль/л;
V
Fe– объем рабочего раствора, взятый для выполнения опыта в колбах на 50 мл, мл.
3. Концентрация рабочего раствора соли железа, моль/л:
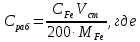
CFe– концентрация стандартного раствора соли железа, г/л;
Vст – объем стандартного раствора, взятый для приготовления рабочего раствора, моль/л;
MFe – молярная масса железа, MFe = 55,84 г/моль;
200 – объем приготовленного раствора соли железа, мл.
4. Константа нестойкости:
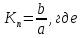
a – линейный член уравнения линии тренда;
b – угловой коэффициент уравнения линии тренда.
5. Изменение энергии Гиббса диссоциации роданидного комплекса железа, кДж/моль:
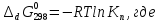
R – универсальная газовая постоянная, Дж·K-1·моль-1;
T – температура, К.
6. Изменение энергия Гиббса образования роданидного комплекса железа, кДж/моль:
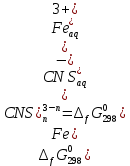
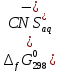
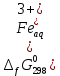
Расчетная часть:
Таблица 3 – Обработка результатов эксперимента
| [Fe]общ, ммоль/л | VKSCN, мл | D | [Fe]общ/D, ммоль/л | [KSCN], моль/л | [KSCN]-1, л/моль | [KSCN]-2, л2/моль2 | [KSCN]-3, л3/моль3 |
| 0,09 | 2 | 0,541 | 0,166 | 0,04 | 25,0 | 625,0 | 15625,0 |
| 0,09 | 3 | 0,594 | 0,152 | 0,06 | 16,7 | 277,8 | 4629,6 |
| 0,09 | 4 | 0,645 | 0,140 | 0,08 | 12,5 | 156,3 | 1953,1 |
| 0,09 | 5 | 0,662 | 0,136 | 0,10 | 10,0 | 100,0 | 1000,0 |
| 0,09 | 6 | 0,682 | 0,132 | 0,12 | 8,3 | 69,4 | 578,7 |
| 0,09 | 7 | 0,718 | 0,125 | 0,14 | 7,1 | 51,0 | 364,4 |
| 0,09 | 8 | 0,779 | 0,116 | 0,16 | 6,3 | 39,1 | 244,1 |