Файл: Кислотноосновные равновесия. Водородный показатель рН расчет, методы определения. Кислотноосновное равновесие.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 04.12.2023
Просмотров: 14
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Кислотно-основные равновесия.
Водородный показатель рН: расчет, методы определения.
Кислотно-основное равновесие.
Кислотно-основное равновесие – относительное постоянство соотношения кислота-основание внутренней среды живого организма.
Является составной частью гомеостаза. Количественно характеризуется либо концентрацией водородных ионов (протонов) в молях на 1 л, либо водородным показателем pH.
Кислотно-основное равновесие – соотношение определённой концентрации ионов Н+ и ОН- в органах, тканях, жидкостях организма.
Кислотно-основное равновесие имеет первостепенное значение:
-
Ионы Н+ являются катализаторами многих биохимических превращений; -
Ферменты и гормоны проявляют биологическую активность при строго определённых значениях рН; -
Наибольшие изменения концентрации ионов Н+ крови и межтканевой жидкости влияют на величину их осмотического давления.
Основные показатели:
-
В норме рН крови равно 7,4.
Смещение рН в сторону увеличения – алкалоз,
в сторону уменьшения - ацидоз.
Различают респираторный и метаболический ацидоз и алкалоз.
-
Парциальное давление СО2 в норме составляет 40 мм рт.ст. Снижение этого показателя наблюдается при дыхательном алкалозе и метаболическом ацидозе. Повышение давления СО2 отмечается при дыхательном ацидозе и метаболическом алкалозе.
-
Щелочной резерв крови. Количество мл СО2, находящегося в крови, в расчете на 100 мл сыворотки крови. Норма – 55%.
Уменьшение резервной щелочности свидетельствует об уменьшении содержания бикарбонатов в организме, а увеличение её – об их увеличении.
Величина рН. Шкала рН и значения рН в организме человека.
От величины рН зависит стабильность мембран, функции ферментов, диссоциация электролитов, нервно-мышечная возбудимость и проводимость, комплексообразование и другие процессы.
Кислотно-основная система представляет собой соотношение между концентрациями активных масс водородных и гидроксильных (основных) ионов.
Сдвиг рН на ± 0,1 по сравнению с физиологической нормой приводит к расстройству дыхания и кровообращения,
на ± 0,3 – потере сознания,
в диапазоне ± 0,4 – гибели организма.

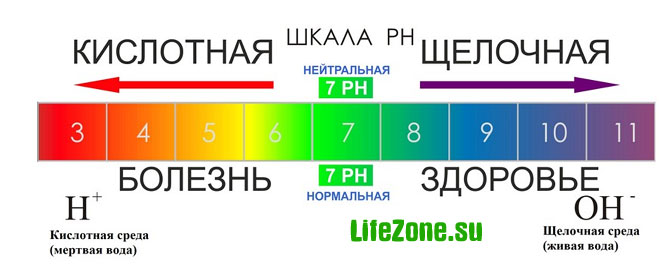
Значение pH в организме человека:
pH мозг – 7,1
pH слюна – 6,0-7,4
pH желудочный сок = 1,0-3,5
pH желчь – 7,8
pH печень – 7,2
pH панкреатическая секреция – 8,0-8,3
pH моча – 4,5-8,0
pH кости – 7,4
pH мускулы – 6,9-7,2
pH секрет тонкой кишки – 7,5-8,0
pH венозная кровь – 7,3-7,35
pH артериальная кровь – 7,4-7,45
pH капиллярная кровь – 7,35-7,4
pH сердце - 7,0-7,4
Буферные системы и буферная ёмкость.
Буферные растворы – растворы, поддерживающие определенную концентрацию ионов водорода (рН) при разбавлении и незначительно изменяющие ее при добавлении небольших количеств сильных кислот или щелочей.
К ним относятся:
1. Растворы, содержащие слабую кислоту и соль этой кислоты и сильного основания (СН3СООН + СН3СООNa);
2. Растворы, содержащие слабое основание и соль этого основания и сильной кислоты (NH4OH + NH4Cl);
3. Растворы, содержащие смесь солей слабых многоосновных кислот (Na2HPO4 + NaH2PO4);
4. Растворы, содержащие смесь средней гидролизующейся соли и кислой соли этой же кислоты (NaHCO3 + Na2CO3).
Расчет рН буферного раствора производят по формулам:
Буферная смесь – количество вещества эквивалента сильной кислоты или щелочи, необходимое для смещения рН 1 л буферного раствора на одну единицу.
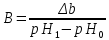
Буферная емкость раствора тем выше, чем больше концентрации компонентов и чем меньше эти концентрации различаются между собой.
Разбавление раствора не влияет на изменение рН, но сильно влияет на величину буферной емкости.
Поддержание постоянного уровня рН в крови и тканевых жидкостях достигается благодаря наличию нескольких буферных систем.
Важнейшие буферные системы:
1. Гидрокарбонатная буферная система – равновесием молекул слабой угольной кислоты с образующимися при ее диссоциации гидрокарбонат-ионами:
НСО3¯ + Н+ ↔ Н2СО3
НСО3¯ + Н2О ↔ Н2СО3 + ОН¯
2. Фосфатная буферная система характеризуется равновесием:
HPO42ˉ + H+ ↔ H2PO4¯
НРО42ˉ + Н2О ↔ Н2РО4¯ + ОН¯
3. Буферная система оксигемоглобин-гемоглобин, на долю которой приходится приблизительно 75% емкости крови, характеризуется равновесием между ионами гемоглобина и самим гемоглобином.
Таким образом, все буферные системы крови и тканевых жидкостей образуют единую взаимосвязанную систему.
Основы метода потенциометрии. Уравнение Нернста.
Стеклянный электрод.
Потенциометрия – один из самых простых электроаналитических методов. Прежде всего он используется для измерения pH, а также для установления ионного состава биологических жидкостей (кровь, моча). Это также способ преобразования селективных взаимодействий в аналитических сигнал в молекулярных сенсорных устройствах или процессе химической реакции.
Потенциометрия основана на измерении потенциала ячейки, т.е. разности потенциалов между двумя электродами в отсутствии тока во внешней цепи. Потенциал и область применения индикатора электрода зависят от его природы и селективности.
Два приема:
-
Прямая потенциометрия – измерение потенциала как функции активности определяемого компонента;
-
Потенциометрическое титрование – измерение потенциала электрода как функции объема реагента, добавленного к пробе.
Уравнение Нернста – уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
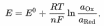
Стеклянные электроды – распространенные, удобные в обращении, ионоселективные электроды. С их помощью определяют рН растворов, концентрацию ионов Na
+, K+.
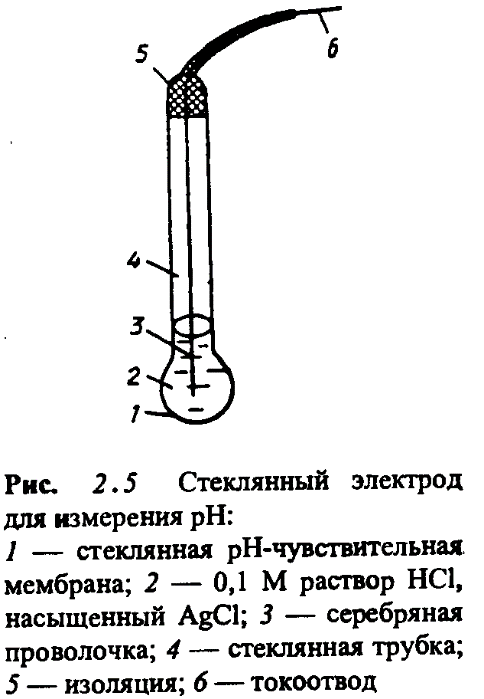
Пригоден для определения рН в интервале от 0 до 12. Для разных участков этого интервала применяют стеклянные электроды из разных стекол.
 Недостатком стеклянного электрода является хрупкость стеклянной мембраны, а также возможность избирательной адсорбции некоторых ионов стеклянной поверхностью электрода, вследствие чего возникают ошибки при измерении.
Недостатком стеклянного электрода является хрупкость стеклянной мембраны, а также возможность избирательной адсорбции некоторых ионов стеклянной поверхностью электрода, вследствие чего возникают ошибки при измерении. Стеклянные электроды для измерения рН применяют в приборах, называемых рН - метрами.
Шкалы рН - метров градуированы в единицах рН.