ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 04.12.2023
Просмотров: 95
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
,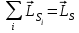 ,
,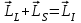 . (1.3.1)
. (1.3.1)
Моменттерді қосудың осы амалы қалыпты (немесе LS) деп аталатын байланыс жағдайына сәйкес келеді. Байланыстың осы түрі, әдетте, жеңіл және онша ауыр емес атомдарға тән.
Қалыпты байланыс электрондардың өзара электрстатикалық әсерлесуі (бұлардың кулондық тебілісі) спин-орбиталық әсерлесумен (спиндік және орбиталық моменттердің магниттік әсерлесуі) салыстырғанда үлкен болғанда орын алады. Электрстатикалық әсерлесу энергияның L және S кванттық сандарынан тәуелділігін анықтайды, ал бұған салыстырғанда кіші магниттік әсерлесу – L және S мәндері берілгенде энергияның J кванттық санынан тәуелділігін (мультиплеттік жіктелу) анықтайды.
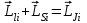 ,
,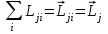 . (1.3.2)
. (1.3.2)
Моменттердің осылай қосылуы (jj) байланыс жағдайына сәйкес келеді. (jj) байланыс жеке электронның магниттік спин-орбиталық әсерлесуі әр түрлі электрондардың өзара электрстатикалық әсерлесуіне салыстырғанда үлкен болғанда орын алады. Энергия алдымен jiмәндеріне тәуелді болады, бұдан кейін ғана берілген ji мәндерінде J мәндеріне тәуелді болады. Мұндай байланыс ауыр атомдарға тән, бірақ өте сирек кездеседі.
Атомның L механикалық моментімен магниттік момент байланысқан болады. Сонда L және шамалары бір-бірінен тұрақты көбейткішпен ғана өзгеше болатындықтан, бұлардың қасиеттері ұқсас: магниттік және механикалық моменттер бірдей ережелер бойынша квантталады.
Стационарлық күйде тек L магниттік моменті модулінің және оның проекциялары біреуінің кезкелген z өсіне проекциясының нақты мәндері болады. Атомның L
L орбиталық механикалық моменті және оның z өсіне LLz проекциясы:
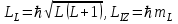 . (1.4.1)
. (1.4.1)
Атомның орбиталық магниттік моменті және оның z осіне проекциясы:
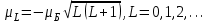 (1.4.2)
(1.4.2)
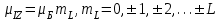 (1.4.3)
(1.4.3)
Спиндік магниттік момент және оның z өсіне проекциясы:
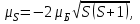 (1.4.4)
(1.4.4)
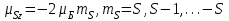 (1.4.5)
(1.4.5)
(1.4.4)және (1.4.5) теңделеурінен анықталады, мұндағы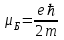 – Бор магнетоны.
– Бор магнетоны.
S=1/2 болғанда (бір электрон жағдайы) mS=+1/2 және -1/2.
Атомның толық магниттік моменті және оның z өсіне проекциясы:
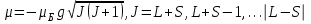 (1.4.6)
(1.4.6)
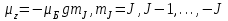 , (1.4.7)
, (1.4.7)
Мұндағы g – Ланде факторы (көбейткіші):
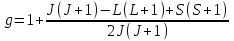 . (1.4.8)
. (1.4.8)
10. Көп электронды атомдардың термдері. Күрделі атомдардың негізгі күйлері. Хунд ережесі.
Күйлердің белгіленуі. Атомдағы электронның әр түрлі күйлерін l орбиталық кванттық санының мәніне байланысты латын әліпбиінің кіші әріптерімен белгілеу қабылданған:
Nбаскванттықсанмәніберілгенlкүйбелгісініңалдынакөрсетіледі:
1s; 2s; 2p; 3s, 3p, 3d;… (1.2.13)
Сұрыптауережелері: атомдағыэлектрондардыңэлектрмагниттіксәулені (жарықты)шығаруыжәнежұтуыменбайланыстымүмкінболатынкванттықауысуларыншектейтінережелер:
lорбиталықкванттықсанбойынша:∆l = ±1, яғниорбиталықкванттықсан 1-геөзгеретінауысуларғанамүмкінболады.
тмагниттіккванттықсанбойынша: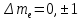
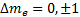 , яғниосышарторындалатынауысуларғанамүмкінболады.
, яғниосышарторындалатынауысуларғанамүмкінболады.
11. Атомдардың электрондық қабықтарын толтыру. Термнің нәзік түзілісі. Менделеевтің элементтердің периодтық жүйесін физикалық түсіндірілуі.
Берілген n мәніне l, mi, msкванттық сандары бойынша бір-бірінен өзгеше болатын 2n2 күй сәйкес келеді. Атомның n кванттық сан мәндері бірдей электрондарының жиыны электрондық қабат құрайды. n мәніне сәйкес қабаттар былай белгіленеді:
Толық толтырылған қабаттармен қабықтарда L=0 және S=0, демек, J=0
болады. Мысалы, 3p-қабық: қосынды кванттық сан
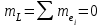 және бұл жалғыз мән, сондықтан L=0. Қосынды кванттық сан
және бұл жалғыз мән, сондықтан L=0. Қосынды кванттық сан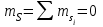 , сондықтан S=0. Демек, J=0.
, сондықтан S=0. Демек, J=0.
Бұл маңызды нәтиже: атомының L және S кванттық сандарынан ықтағанда толған қабықтарды ескермеуге болады.
Электрондардың күйлер бойынша үлестірілуі электрондық конфигурация деп аталады. Бұл былай белгіленеді, мысалы, Na атомының электрондық конфигурациясы:
1s22s22p63s.
Электрондармен толық толтырылған қабатты (немесе қабықты) тұйықталған дейді. Тұйықталған қабаттың (және қабықтың) барлық үш кванттық саны (L, S, J) нөлге тең болады. Осындай қабаттардың негізгі термдері –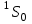 .
.
Әрбір қабықтағы электрондарды эквиваленттік электрондар деп атайды, бұлардың n және l мәндері бірдей болады.
Атомдардың химиялық және бірқатар физикалық қасиеттерінің бақыланатын периодтылығы сыртқы валенттік электрондардың тәртібімен түсіндіріледі. Осы периодтылық атомдардың электрондық конфигурациясының белгілі периодтылығымен, соның ішіндесыртқы электрондардың конфигурациясымен байланысты екендігі анықталған.
16. Кванттық күшейту және генерациялау физикасын түсіндіріңіз. Лазердің қалай жұмыс істейтінін сипаттаңыз.
Кванттық күшейткіш– қоздырылған атомдардың, молекулалардың, иондардың еріксіз сәуле шығаруы кезінде пайда болған электрмагниттік толқындарды күшейтуге арналған құрылғы.Кванттық күшейткіштің күшейту әсері, қозғалысы кванттық механика заңдарына бағынатын атом ішіндегі электрондар энергиясының өзгеруіне негізделген. Қоздырылған атом бейтарап күйге еріксіз және өздігінен (ерікті) кванттық ауысулар арқылы келеді. Әрбір еріксіз ауысу актісі кезінде энергиясы hv-ге тең электрмагниттік квант бөлініп шығады. Мұндай жағдайда бөлініп шыққан электрмагниттік кванттың жиілігі (v), фазасы және бағыты, оған себепші болған бастапқы сәуленің жиілігімен (v), фазасымен және бағытымен бірдей болады.
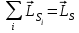 ,
,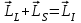 . (1.3.1)
. (1.3.1)Моменттерді қосудың осы амалы қалыпты (немесе LS) деп аталатын байланыс жағдайына сәйкес келеді. Байланыстың осы түрі, әдетте, жеңіл және онша ауыр емес атомдарға тән.
Қалыпты байланыс электрондардың өзара электрстатикалық әсерлесуі (бұлардың кулондық тебілісі) спин-орбиталық әсерлесумен (спиндік және орбиталық моменттердің магниттік әсерлесуі) салыстырғанда үлкен болғанда орын алады. Электрстатикалық әсерлесу энергияның L және S кванттық сандарынан тәуелділігін анықтайды, ал бұған салыстырғанда кіші магниттік әсерлесу – L және S мәндері берілгенде энергияның J кванттық санынан тәуелділігін (мультиплеттік жіктелу) анықтайды.
-
Әрбір электрон үшін оның орбиталық және спиндік
және спиндік  моменттері берілген электронның толық
моменттері берілген электронның толық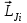 моментіне қосылады, бұдан кейін жеке электрондардың толық моменттері атомның толық моментіне қосылады:
моментіне қосылады, бұдан кейін жеке электрондардың толық моменттері атомның толық моментіне қосылады:
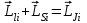 ,
,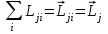 . (1.3.2)
. (1.3.2)Моменттердің осылай қосылуы (jj) байланыс жағдайына сәйкес келеді. (jj) байланыс жеке электронның магниттік спин-орбиталық әсерлесуі әр түрлі электрондардың өзара электрстатикалық әсерлесуіне салыстырғанда үлкен болғанда орын алады. Энергия алдымен jiмәндеріне тәуелді болады, бұдан кейін ғана берілген ji мәндерінде J мәндеріне тәуелді болады. Мұндай байланыс ауыр атомдарға тән, бірақ өте сирек кездеседі.
Атомның L механикалық моментімен магниттік момент байланысқан болады. Сонда L және шамалары бір-бірінен тұрақты көбейткішпен ғана өзгеше болатындықтан, бұлардың қасиеттері ұқсас: магниттік және механикалық моменттер бірдей ережелер бойынша квантталады.
Стационарлық күйде тек L магниттік моменті модулінің және оның проекциялары біреуінің кезкелген z өсіне проекциясының нақты мәндері болады. Атомның L
L орбиталық механикалық моменті және оның z өсіне LLz проекциясы:
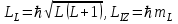 . (1.4.1)
. (1.4.1)Атомның орбиталық магниттік моменті және оның z осіне проекциясы:
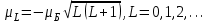 (1.4.2)
(1.4.2)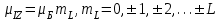 (1.4.3)
(1.4.3)Спиндік магниттік момент және оның z өсіне проекциясы:
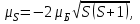 (1.4.4)
(1.4.4)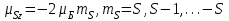 (1.4.5)
(1.4.5)(1.4.4)және (1.4.5) теңделеурінен анықталады, мұндағы
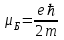 – Бор магнетоны.
– Бор магнетоны.S=1/2 болғанда (бір электрон жағдайы) mS=+1/2 және -1/2.
Атомның толық магниттік моменті және оның z өсіне проекциясы:
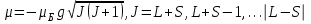 (1.4.6)
(1.4.6)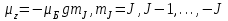 , (1.4.7)
, (1.4.7)Мұндағы g – Ланде факторы (көбейткіші):
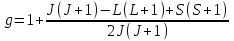 . (1.4.8)
. (1.4.8)10. Көп электронды атомдардың термдері. Күрделі атомдардың негізгі күйлері. Хунд ережесі.
Күйлердің белгіленуі. Атомдағы электронның әр түрлі күйлерін l орбиталық кванттық санының мәніне байланысты латын әліпбиінің кіші әріптерімен белгілеу қабылданған:
| кванттық саны | 0 | 1 | 2 | 3 | 4 | 5 | (1.2.12) |
| Күй белгісі | s | p | d | f | g | H | |
Nбаскванттықсанмәніберілгенlкүйбелгісініңалдынакөрсетіледі:
1s; 2s; 2p; 3s, 3p, 3d;… (1.2.13)
Сұрыптауережелері: атомдағыэлектрондардыңэлектрмагниттіксәулені (жарықты)шығаруыжәнежұтуыменбайланыстымүмкінболатынкванттықауысуларыншектейтінережелер:
lорбиталықкванттықсанбойынша:∆l = ±1, яғниорбиталықкванттықсан 1-геөзгеретінауысуларғанамүмкінболады.
тмагниттіккванттықсанбойынша:
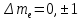
-
Хунд ережелері: Бұл эквивалентті электрондар жүйесіне (бұлардың n және l кванттық сандары бірдей) қатысты, яғни бір қабықта орналасқан электрондар үшін ережелер:
-
Берілген электрондық конфигурацияның ең кіші энергиясына мүмкін болатын ең үлкен S спині мәні бар және осындай S жағдайында мүмкін болатын ең үлкен L мәні бар терм ие болады. -
Осы жағдайда, егер қабықтың толтырылуы жартысынан аз болса, онда J=|L-S|, қалған басқа жағдайларда J=L+S болады.
11. Атомдардың электрондық қабықтарын толтыру. Термнің нәзік түзілісі. Менделеевтің элементтердің периодтық жүйесін физикалық түсіндірілуі.
Берілген n мәніне l, mi, msкванттық сандары бойынша бір-бірінен өзгеше болатын 2n2 күй сәйкес келеді. Атомның n кванттық сан мәндері бірдей электрондарының жиыны электрондық қабат құрайды. n мәніне сәйкес қабаттар былай белгіленеді:
| n | 1 | 2 | 3 | 4 | 5 | 6 |
| қабат | K | L | M | N | O | P |
Қабаттар l кванттық саны бойынша қабықтарға бөлінеді. Қабықтағы әртүрлі күйлер me және msкванттық сан мәндері бойынша өзгеше болады. Қабықтағы күйлердің саны 2(2l+1)-ге тең. Қабықтар былай белгіленеді:
1s; 2s, 2p; 3s,3p,3d,…,
мұндағы 1, 2,... сандары n кванттық сан мәндері, яғни қабықтың тиісті қабатқа (K, L,..) жататындығын көрсетеді.
Атомдағы электрондардың мүмкін болатын күйлері және олардың қабаттар мен қабықтар бойынша үлестірілуі 1-кестеде көрсетілген, мұнда 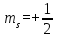 және
және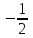 белгілеулер орнын көрнекілік үшін ↓ және ↑ белгілері алынған. K, L, M,... қабаттарында мүмкін болатын күйлер саны тиісінше, 2, 8, 18,...-ге тең, яғни 2n2-болатындығы көрінеді.
белгілеулер орнын көрнекілік үшін ↓ және ↑ белгілері алынған. K, L, M,... қабаттарында мүмкін болатын күйлер саны тиісінше, 2, 8, 18,...-ге тең, яғни 2n2-болатындығы көрінеді.
Қабаттар l кванттық саны бойынша қабықтарға бөлінеді. Қабықтағы әртүрлі күйлер me және msкванттық сан мәндері бойынша өзгеше болады. Қабықтағы күйлердің саны 2(2l+1)-ге тең. Қабықтар былай белгіленеді:
1s; 2s, 2p; 3s,3p,3d,…,
мұндағы 1, 2,... сандары n кванттық сан мәндері, яғни қабықтың тиісті қабатқа (K, L,..) жататындығын көрсетеді.
Атомдағы электрондардың мүмкін болатын күйлері және олардың қабаттар мен қабықтар бойынша үлестірілуі 1-кестеде көрсетілген, мұнда 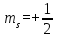 және
және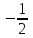 белгілеулер орнын көрнекілік үшін ↓ және ↑ белгілері алынған. K, L, M,... қабаттарында мүмкін болатын күйлер саны тиісінше, 2, 8, 18,...-ге тең, яғни 2n2-болатындығы көрінеді.
белгілеулер орнын көрнекілік үшін ↓ және ↑ белгілері алынған. K, L, M,... қабаттарында мүмкін болатын күйлер саны тиісінше, 2, 8, 18,...-ге тең, яғни 2n2-болатындығы көрінеді.
Қабаттар l кванттық саны бойынша қабықтарға бөлінеді. Қабықтағы әртүрлі күйлер me және msкванттық сан мәндері бойынша өзгеше болады. Қабықтағы күйлердің саны 2(2l+1)-ге тең. Қабықтар былай белгіленеді:
1s; 2s, 2p; 3s,3p,3d,…,
мұндағы 1, 2,... сандары n кванттық сан мәндері, яғни қабықтың тиісті қабатқа (K, L,..) жататындығын көрсетеді.
Атомдағы электрондардың мүмкін болатын күйлері және олардың қабаттар мен қабықтар бойынша үлестірілуі 1-кестеде көрсетілген, мұнда 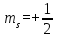 және
және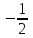 белгілеулер орнын көрнекілік үшін ↓ және ↑ белгілері алынған. K, L, M,... қабаттарында мүмкін болатын күйлер саны тиісінше, 2, 8, 18,...-ге тең, яғни 2n2-болатындығы көрінеді.
белгілеулер орнын көрнекілік үшін ↓ және ↑ белгілері алынған. K, L, M,... қабаттарында мүмкін болатын күйлер саны тиісінше, 2, 8, 18,...-ге тең, яғни 2n2-болатындығы көрінеді.
| n | 1 | 2 | 3 | ||||||||||||||
| қабат | K | L | M | ||||||||||||||
| қабық (n.l) | 1s | 2s | 2p | 3s | 3p | 3d | |||||||||||
| ml ms | 0 ↑↓ | 0 ↑↓ | +1 ↑↓ | 0 ↑↓ | -1 ↑↓ | 0 ↑↓ | +1 ↑↓ | 0 ↑↓ | -1 ↑↓ | +2 ↑↓ | +1 ↑↓ | 0 ↑↓ | -1 ↑↓ | -2 ↑↓ | |||
| Электрон саны | 2 | 2 | 6 | 2 | 6 | 10 | |||||||||||
Толық толтырылған қабаттармен қабықтарда L=0 және S=0, демек, J=0
болады. Мысалы, 3p-қабық: қосынды кванттық сан
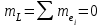 және бұл жалғыз мән, сондықтан L=0. Қосынды кванттық сан
және бұл жалғыз мән, сондықтан L=0. Қосынды кванттық сан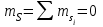 , сондықтан S=0. Демек, J=0.
, сондықтан S=0. Демек, J=0.Бұл маңызды нәтиже: атомының L және S кванттық сандарынан ықтағанда толған қабықтарды ескермеуге болады.
Электрондардың күйлер бойынша үлестірілуі электрондық конфигурация деп аталады. Бұл былай белгіленеді, мысалы, Na атомының электрондық конфигурациясы:
1s22s22p63s.
Электрондармен толық толтырылған қабатты (немесе қабықты) тұйықталған дейді. Тұйықталған қабаттың (және қабықтың) барлық үш кванттық саны (L, S, J) нөлге тең болады. Осындай қабаттардың негізгі термдері –
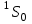 .
. Әрбір қабықтағы электрондарды эквиваленттік электрондар деп атайды, бұлардың n және l мәндері бірдей болады.
Атомдардың химиялық және бірқатар физикалық қасиеттерінің бақыланатын периодтылығы сыртқы валенттік электрондардың тәртібімен түсіндіріледі. Осы периодтылық атомдардың электрондық конфигурациясының белгілі периодтылығымен, соның ішіндесыртқы электрондардың конфигурациясымен байланысты екендігі анықталған.
16. Кванттық күшейту және генерациялау физикасын түсіндіріңіз. Лазердің қалай жұмыс істейтінін сипаттаңыз.
Кванттық күшейткіш– қоздырылған атомдардың, молекулалардың, иондардың еріксіз сәуле шығаруы кезінде пайда болған электрмагниттік толқындарды күшейтуге арналған құрылғы.Кванттық күшейткіштің күшейту әсері, қозғалысы кванттық механика заңдарына бағынатын атом ішіндегі электрондар энергиясының өзгеруіне негізделген. Қоздырылған атом бейтарап күйге еріксіз және өздігінен (ерікті) кванттық ауысулар арқылы келеді. Әрбір еріксіз ауысу актісі кезінде энергиясы hv-ге тең электрмагниттік квант бөлініп шығады. Мұндай жағдайда бөлініп шыққан электрмагниттік кванттың жиілігі (v), фазасы және бағыты, оған себепші болған бастапқы сәуленің жиілігімен (v), фазасымен және бағытымен бірдей болады.