Добавлен: 06.12.2023
Просмотров: 130
Скачиваний: 5
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Министерство образования и науки РФ
Федеральное государственное бюджетное образовательное учреждение Высшего образования
«Уфимский государственный нефтяной технический университет»
Кафедра «Прикладные и естественнонаучные дисциплины»
РЕФЕРАТ
ТЕМА: «Ионная химическая связь. »
Выполнила: ст.гр. БФПП-22-01
Сафина М.Р.
Проверила: Хайбуллин М.М
Уфа – 2023
СОДЕРЖАНИЕ
-
Ионная связь 3
1.2 Взаимодействие ионов 3
1.2 Определение Ионной связи 4
1.3 Ионные радиусы 6
1.4 Энергия ионной связи 8
1.5 Поляризация ионов 10
1.6 Влияние поляризации ионов на свойства веществ и свойства Ионной связи и ионных соединений 12
1.7 Кристаллическая решётка 14
-
Ионная связь
Теория химической связи занимает важнейшее место в современной химии. Она объясняет, почему атомы объединяются в химические частицы, и позволяет сравнивать устойчивость этих частиц. Используя теорию химической связи, можно предсказать состав и строение различных соединений. Понятие о разрыве одних химических связей и образовании других лежит в основе современных представлений о превращениях веществ в ходе химических реакций.
Химическая связь - это взаимодействие атомов, обусловливающее устойчивость химической частицы или кристалла как целого. Химическая связь образуется за счет электростатического взаимодействия между заряженными частицами: катионами и анионами, ядрами и электронами. При сближении атомов начинают действовать силы притяжения между ядром одного атома и электронами другого, а также силы отталкивания между ядрами и между электронами. На некотором расстоянии эти силы уравновешивают друг друга, и образуется устойчивая химическая частица.
При образовании химической связи может произойти существенное перераспределение электронной плотности атомов в соединении по сравнению со свободными атомами.
В предельном случае это приводит к образованию заряженных частиц - ионов (от греческого "ион" - идущий).
1.1 Взаимодействие ионов
Если атом теряет один или несколько электронов, то он превращается в положительный ион - катион (в переводе с греческого – «идущий вниз»). Так образуются катионы водорода Н+, лития Li+, бария Ва
2+. Приобретая электроны, атомы превращаются в отрицательные ионы - анионы (от греческого "анион" - идущий вверх). Примерами анионов являются фторид ион F−, сульфид-ион S2−.
Катионы и анионы способны притягиваться друг к другу. При этом возникает химическая связь, и образуются химические соединения. Такой тип химической связи называется ионной связью:
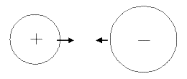
1.2 Определение Ионной связи
Ионная связь - это химическая связь, образованная за счет электростатического притяжения между катионами и анионами.
Механизм образования ионной связи можно рассмотреть на примере реакции между натрием и хлором. Атом щелочного металла легко теряет электрон, а атом галогена - приобретает. В результате этого возникает катион натрия и хлорид-ион. Они образуют соединение за счет электростатического притяжения между ними.
Взаимодействие между катионами и анионами не зависит от направления, поэтому о ионной связи говорят как о ненаправленной. Каждый катион может притягивать любое число анионов, и наоборот. Вот почему ионная связь является ненасыщенной. Число взаимодействий между ионами в твердом состоянии ограничивается лишь размерами кристалла. Поэтому "молекулой" ионного соединения следует считать весь кристалл.
Для возникновения ионной связи необходимо, чтобы сумма значений энергии ионизации Ei (для образования катиона) и сродства к электрону Ae (для образования аниона) должна быть энергетически выгодной. Это ограничивает образование ионной связи атомами активных металлов (элементы IA- и IIA-групп, некоторые элементы IIIA-группы и некоторые переходные элементы) и активных неметаллов (галогены, халькогены, азот).
Идеальной ионной связи практически не существует. Даже в тех соединениях, которые обычно относят к ионным, не происходит полного перехода электронов от одного атома к другому; электроны частично остаются в общем пользовании. Так, связь во фториде лития на 80% ионная, а на 20% - ковалентная. Поэтому правильнее говорить о степени ионности (полярности) ковалентной химической связи. Считают, что при разности электроотрицательностей элементов 2,1 связь является на 50% ионной. При большей разности соединение можно считать ионным.
Ионной моделью химической связи широко пользуются для описания свойств многих веществ, в первую очередь, соединений щелочных и щелочноземельных металлов с неметаллами. Это обусловлено простотой описания таких соединений: считают, что они построены из несжимаемых заряженных сфер, отвечающих катионам и анионам. При этом ионы стремятся расположиться таким образом, чтобы силы притяжения между ними были максимальными, а силы отталкивания - минимальными.
Ионная связь — прочная химическая связь, образующаяся между атомами с большой разностью (>1,7 по шкале Полинга) электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью. Это притяжение ионов как разноименно заряженных тел. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %.
Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы.
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ЭО > 1.7 по Полингу), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов:
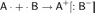
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью. Вернее, такой взгляд удобен. На деле ионная связь между атомами в чистом виде не реализуется нигде или почти нигде, обычно на деле связь носит частично ионный, и частично ковалентный характер. В то же время связь сложных молекулярных ионов часто может считаться чисто ионной. Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости. Именно поэтому кристаллы, образованные за счёт ионной связи, тяготеют к различным плотнейшим упаковкам соответствующих ионов.
1.3 Ионные радиусы
В простой электростатической модели ионной связи используется понятие ионных радиусов. Сумма радиусов соседних катиона и аниона должна равняться соответстующему межъядерному расстоянию:
r0 = r+ + r−
При этом остается неясным, где следует провести границу между катионом и анионом. Сегодня известно, что чисто ионной связи не существует, так как всегда имеется некоторое перекрывание электронных облаков. Для вычисления радиусов ионов используют методы исследования, которые позволяют определять электронную плотность между двумя атомами. Межъядерное расстояние делят в точке, где электронная плотность минимальна.

Размеры иона зависят от многих факторов. При постоянном заряде иона с ростом порядкового номера (а, следовательно, заряда ядра) ионный радиус уменьшается. Это особенно хорошо заметно в ряду лантаноидов, где ионные радиусы монотонно меняются от 117 пм для (La
3+) до 100 пм (Lu3+) при координационном числе 6. Этот эффект носит название лантаноидного сжатия.
В группах элементов ионные радиусы в целом увеличиваются с ростом порядкового номера. Однако для d-элементов четвертого и пятого периодов вследствие лантаноидного сжатия может произойти даже уменьшение ионного радиуса (например, от 73 пм у Zr4+ до 72 пм у Hf4+ при координационном числе 4).
В периоде происходит заметно уменьшение ионного радиуса, связанное с усилением притяжения электронов к ядру при одновременном росте заряда ядра и заряда самого иона: 116 пм у Na+, 86 пм у Mg2+, 68 пм у Al3+ (координационное число 6). По этой же причине увеличение заряда иона приводит к уменьшению ионного радиуса для одного элемента: Fe2+ 77 пм, Fe3+ 63 пм, Fe6+ 39 пм (координационное число 4).
Сравнение ионных радиусов можно проводить только при одинаковом координационном числе, поскольку оно оказывает влияние на размер иона из-за сил отталкивания между противоионами. Это хорошо видно на примере иона Ag+; его ионных радиус равен 81, 114 и 129 пм для координационных чисел 2, 4 и 6, соответственно.
Структура идеального ионного соединения, обусловленная максимальным притяжением между разноименными ионами и минимальным отталкиванием одноименных ионов, во многом определяется соотношением ионных радиусов катионов и анионов. Это можно показать простыми геометрическими построениями.
| Отношение r+ : r− | Координационное число катиона | Окружение | Пример |
| 0,225−0,414 | 4 | Тетраэдрическое | ZnS |
| 0,414−0,732 | 6 | Октаэдрическое | NaCl |
| 0,732−1,000 | 8 | Кубическое | CsCl |
| >1,000 | 12 | Додекаэдрическое | В ионных кристаллах не обнаружено |
1.4 Энергия ионной связи
Энергия связи для ионного соединения - это энергия
, которая выделяется при его образовании из бесконечно удаленных друг от друга газообразных противоионов. Рассмотрение только электростатических сил соответствует около 90% от общей энергии взаимодействия, которая включает также вклад неэлектростатических сил (например, отталкивание электронных оболочек).
При возникновении ионной связи между двумя свободными ионами энергия их притяжения определяется законом Кулона:
E(прит.) = q+ q− / (4π r ε),
где q+ и q− - заряды взаимодействующих ионов, r - расстояние между ними, ε - диэлектрическая проницаемость среды.
Так как один из зарядов отрицателен, то значение энергии также будет отрицательным.
Согласно закону Кулона, на бесконечно малых расстояниях энергия притяжения должна стать бесконечно большой. Однако этого не происходит, так как ионы не являются точечными зарядами. При сближении ионов между ними возникают силы отталкивания, обусловленные взаимодействием электронных облаков. Энергия отталкивания ионов описывается уравнением Борна:
Е(отт.) = В / rn,
где В - некоторая константа, n может принимать значения от 5 до 12 (зависит от размера ионов). Общая энергия определяется суммой энергий притяжения и отталкивания:
Е = Е(прит.) + Е(отт.)
Её значение проходит через минимум. Координаты точки минимума отвечают равновесному расстоянию r0 и равновесной энергии взаимодействия между ионами E0:
E0 = q+ q− (1 - 1 / n) / (4π r0 ε)
В кристаллической решетке всегда имеет место большее число взаимодействий, чем между парой ионов. Это число определяется в первую очередь типом кристаллической решетки. Для учета всех взаимодействий (ослабевающих с увеличением расстояния) в выражение для энергии ионной кристаллической решетки вводят так называемую константу Маделунга А:
E(прит.) = A q+ q− / (4π r ε)
Значение константы Маделунга определяется только геометрией решетки и не зависит от радиуса и заряда ионов. Например, для хлорида натрия она равна 1,74756.
1.5 Поляризация ионов
Помимо величины заряда и радиуса важной характеристикой иона являются его поляризационные свойства. Рассмотрим этот вопрос несколько подробнее. У неполярных частиц (атомов, ионов, молекул) центры тяжести положительных и отрицательных зарядов совпадают. В электрическом поле происходит смещение электронных оболочек в направлении положительно заряженной пластины, а ядер - в направлении отрицательно заряженной пластины. Вследствие деформации частицы в ней возникает диполь, она становится полярной.