Файл: Лабораторная работа 2 по дисциплине Химия Вариант 08 студент группы 0793208асз Маматов Сергей Владимирович.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 06.12.2023
Просмотров: 17
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ЖЕЛЕЗНОДОРОЖНОГО ТРАНСПОРТА
Федеральное государственное бюджетное образовательное
учреждение высшего образования
«ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ
УНИВЕРСИТЕТ ПУТЕЙ СООБЩЕНИЯ ИМПЕРАТОРА АЛЕКСАНДРА I»
Кафедра «Инженерная химия и естествознание»
ЛАБОРАТОРНАЯ РАБОТА № 2
по дисциплине «Химия»
Вариант № 08
Выполнил:
студент группы: 07-932-08-АСз
Маматов Сергей Владимирович
Проверила:
Масленникова Людмила Леонидовна
Санкт-Петербург – 2019
Химическая идентификация (обнаружение) и измерения веществ.
Цели работы: Идентификация анализируемых растворов на присутствие в них опасных ионов (качественный анализ); устранение опасных ионов осаждением с помощью раствора щелочи; количественная оценка изменения концентрации ионов (количественный анализ).
Химическая идентификация – это ответ на вопрос, какое вещество присутствует в интересующей нас системе (качественный анализ) и сколько этого вещества содержится в системе (количественный анализ). Такое исследование особенно актуально в настоящее время для оценки экологической обстановки. Качественный анализ позволяет определить качество, а количественный дает информацию о том, превышает или нет концентрация вещества его предельно допустимую концентрацию (ПДК) в системе. В основе качественного анализа лежит знание химического поведения веществ, например в виде ионов, по отношению к действию определенной группы соединений, называемых реагентами, а также знание свойств образующихся продуктов реакции (растворимость в воде, кислотах, щелочах, в растворах некоторых веществ (реагентов), способность к образованию веществ сложного состава (комплексообразование).
Это знание особенностей химического поведения веществ позволяет выделить реакции обнарыжения, т.е. такие химические реакции анализируемого вещества с реагентом, при которых образуют продукты, имеющие заметные признаки:
-Образование характерных осадков и их цвета
-Растворение осадков
-Появление (изменение) окраски при растворении осадков
-Выделение газов
Перечисленные признаки являются аналитическим сигналом, под которым понимается различная информация, которую можно зафиксировать визуально (цвет раствора, осадка и др.) либо зафиксировать инструментально и которая свидетельствует о присутствии и количестве того или иного вещества в системе.
Часто в качественном и количественном анализах рассматривается образование осадков в реакции с реагентом, причем в качественном анализе – для идентификации.
Чтобы идентифицировать раствор на присутствие в нем опасного иона, в данной лабораторной работе используется химическая реакция, в результате которой образуется трудно растворимое соединение – осадок.
Цвет и поведение этого осадка с определенным реагентом, дает опорную информацию, указывающую на конкретный ион.
Опишем опыт:
Дана пробирка с исходным раствором. Сравним цвет исходного раствора с данными в таблице №1:

Согласно полученной информации исходный раствор может содержать следующие ионы:
Zn(II), Cd(II), Pb(II), Al(III) или Ba(II).
Для получения осадка (гидроксида), к исходному раствору добавляем 3 капли водного раствора щёлочи (NaOH) и наблюдаем.
Сравним цвет выпавшего осадка с информацией в таблице №2:
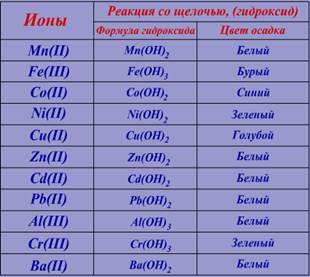
Следовательно в растворе возможно присутствие следующих ионов: Zn(II), Cd(II), Pb(II), Al(III) или Ba(II).
Полученный осадок разделим на 2 части.
К первой части добавим избыток щёлочи (NaOH) и наблюдаем
Сравним результат реакции с информацией в таблице №3:
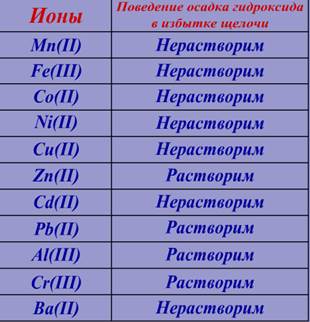
Следовательно в растворе возможно присутствие следующих ионов: Zn(II), Pb(II), Al(ӀӀӀ).
Ко второй части осадка добавим водный раствор аммиака (NH4OH) и наблюдаем.
Сравним результат реакции с информацией в таблице №4:
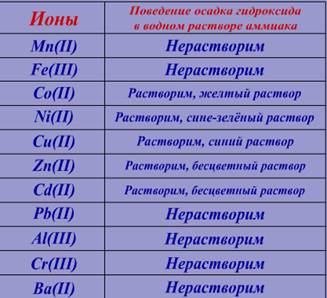
Следовательно в растворе возможно присутствие следующих ионов: Pb(II), Al(ӀӀӀ).
На основании полученной информации, для окончательного вывода о присутствии предполагаемого конкретного иона, проделаем специфическую реакцию: к исходному раствору добавим ализарин и наблюдаем. Цвет раствора окрасился в ярко-красный, следовательно в нём возможно присутствие ионов: Al(ӀӀӀ).
Проделаем тоже самое и для второй пробирки, результаты занесем в таблицу.
| Ионы | Цвет исходного раствора | Реакция со щёлочью, гидроксид | Поведение осадка гидроксида | Специфические реакции | Результат реакции | ||
| формула гидроксида | цвет осадка | в избытке щёлочи | в водном растворе аммиака | ||||
| Al(ӀӀӀ) | Бесцветный | Zn(OH)2 Cd(OH)2 Pb(OH)2 Al(OH)3 Ba(OH)2 | Белый | Zn Pb Al | Pb Al | Ализарин | Ярко-красный цвет. |
| Cr(ӀӀӀ) | Зелёный | Ni(OH)2 Cr(OH)3 | Зелёный | Cr | Cr | Пероксид водорода(H2O2) | Жёлтый цвет. |
Вывод: первый раствор содержит Al(ӀӀӀ), а второй- Cr(ӀӀӀ), что подтверждается проведёнными опытами и их проверкой.