Файл: Отчет по лабораторной работе 4 По дисциплине химия наименование.docx
Добавлен: 07.12.2023
Просмотров: 79
Скачиваний: 4
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ

МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
федеральное государственное бюджетное образовательное учреждение
высшего образования
«САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ»
Кафедра общей химии
Отчет по лабораторной работе №4
По дисциплине ХИМИЯ
(наименование учебной дисциплины согласно учебному плану)
Тема: Исследование окислительно-восстановительных реакций
Автор: студент гр. ПМК-22 Николаев А.А.
(шифр группы) (подпись) (Ф.И.О.)
ОЦЕНКА:
Дата:
ПРОВЕРИЛ
(должность) (подпись) (Ф.И.О.)
Санкт-Петербург
2022 год
Цель работы: познакомиться с наиболее распространенными окислителями и восстановителями, с продуктами их взаимодействия между собой и научиться составлять уравнения окислительно-восстановительных реакций.
Общие сведения.
Окислительно-восстановительными называют реакции, протекающие с изменением степени окисления элементов.
Степень окисления – это гипотетический заряд, который был бы на атомах данного элемента, если бы соединение было построено из ионов.
Высшая степень окисления элемента равна номеру группы периодической системы, в которой данный элемент расположен. Низшая степень окисления равна числу электронов, который может принять данный элемент на застраивающейся np-подуровень: zmin =N-8 , где N – номер группы. Например, у серы высшая степень окисления равна 6, а низшая: 6-8 = -2. В простых веществах степень окисления равна нулю. Многие элементы проявляют в соединениях постоянные значения степени окисления:
фтор –1
кислород –2, кроме перекиси и пероксидов, в которых степень окисления кислорода –1
щелочные металлы +1
щелочноземельные металлы +2
водород кроме гидридов и органических соединений, +1
Степени окисления переменно-валентных элементов рассчитывают по правилу баланса зарядов: «Сумма степеней окисления всех элементов в соединения равна нулю, а в многоатомном ионе - заряду иона»
Рассчитаем степень окисления хрома в дихромате калия K2Cr2O7. Согласно балансу зарядов:
2zK + 2zCr + 7zO = 0.
Подставив zK = 1 и zO = -2, получаем zCr = +6.
Для расчета степени окисления марганца в перманганат-ионе MnO4 составляем уравнение:
zMn + 4zO = -1.
Получаем zMn = +7.
Окислителем называют элемент, который в ходе реакции понижает степень окисления, а восстановителем – элемент, который повышает степень окисления. Окислитель при этом принимает электроны на валентную оболочку, а восстановитель отдаёт электроны.
Правила составления уравнений окислительно-восстановительных реакций следующие. Возьмем в качестве примера восстановление перманганата нитритом калия в нейтральной среде:
KMnO4 + KNO2 + H2O =
1.Определяют степень окисления переменно-валентных элементов, окислитель и восстановитель. Калий, кислород и водород имеют постоянные значения степеней окисления, указанные выше. Вычисляем степени окисления марганца и азота. Поскольку марганец в высшей степени окисления, он является окислителем. Азот может повысить степень окисления до номера группы +5, поэтому он является восстановителем.
2. Составляют ионные уравнения полу реакций окисления и восстановления. Для уравнивания числа атомов кислорода добавляют воду и ионы: H+ в кислой среде или OH- в щелочной среде.
Восстановление: MnO4- + 2H2O + 3ē => MnO2 + 4OH-
Окисление: NO2- + H2O - 2ē => NO3- + 2H+
3. Приводят число электронов к наименьшему общему кратному, в данном примере к 6. Для этого уравнения полу реакций домножают на соответствующие коэффициенты, в примере на 2 и 3. Суммируют уравнения полу реакций, сокращая одинаковые члены в левой и правой частях и учитывая нейтрализацию . В результате получают ионное уравнение реакции:
2MnO4- + 3NO2- + H2O => 2MnO2 + 3NO3- + 2OH-
4. Составляют молекулярное уравнение реакций путём добавления к ионам имеющихся в растворе противоионов.
2KMnO4 + 3KNO2 + H2O => 2MnO2 + 3KNO3 + 2KOH.
Протокол лабораторной работы.
Опыт 1 «Окислительные свойства пероксида водорода»
H2O-2+2KI-+H2SO4=K2SO4+I2+2H2O2-

O- +1ē→O2- 2 окислитель, процесс восстановления
2I--2ē→ I20 1 восстановитель, процесс окисления
После добавления крахмала наблюдается окрашивание бурого раствора в черный.
Опыт 3 «Восстановительные свойства сульфидов»
2K+Mn+7 O-24+8H+2S+6O-24+5Na+2S-2=K+2S+6O+24+2Mn+2S+6O-24+5Na+SO-24+5Na+2S+6O-24+5S0

Mn+7+5ē → Mn+2 2 окислитель, процесс восстановления
S-2 -2ē → S0 5 восстановитель, процесс окисления
Наблюдается изменение раствора с малинового на белый, после добавления сульфида натрия выделяется газ с характерным запахом.
Опыт 5 «Восстановительные свойства сернистой кислоты»
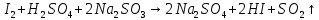

I20+2ē → 2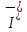 1 окислитель, процесс восстановления
1 окислитель, процесс восстановления
S+4 -2ē → S+6 1 восстановитель, процесс окисления
Наблюдается обесцвечивание раствора.
Опыт 6 «Окислительные свойства нитритов»



2KI-+2NaN+3O2+2H2SO4=I02+Na2SO4+2N+2O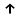 +K2SO4+2H2O
+K2SO4+2H2O
N+3+1 ē N-2 1 окислитель, процесс восстановления
2I-+1 ē I02 2 восстановитель, процесс окисления
Наблюдается окрашивание раствора в коричневый, интенсивное выделение газа.
После добавления крахмала раствор стал темно-синим, что является признаком того, что в продуктах реакции есть йод.
Опыт 7 «Восстановительные свойства нитритов»
2KMn+7O4+5NaN+3O2+3H2SO4=2Mn+2SO4+5NaN+5O2+K2SO4+3H2O


N+3-2 ē N+5 5 окислитель, процесс восстановления

Mn+7+5 ē Mn+2 2 восстановитель, процесс окисления
Наблюдается обесцвечивание малинового раствора.
Опыт 8 «Окислительные свойства дихромата калия»
1)K2Cr+62O7+4H2SO4+ 3NaS+4O3=Cr+3(SO4)3 +3Na2S+6O4+K2SO4+4H2O


2Cr+6 +6 ē Cr+32 1 окислитель, процесс восстановления

S+4 -2 ē S+6 3 восстановитель, процесс окисления
Наблюдается окрашивание раствора в зеленый.
2) K2Сr+6O7+7H2SO4+6KI-1 =K2SO4+Cr2(SO4)3+3I02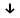

2Cr+6+6ē→Cr2+2 1 окислитель, процесс восстановления
2I-1-2ē→ I02 3 восстановитель, процесс окисления
Наблюдается изменение цвета на коричневый, образование осадка.
3) K2Cr+6O7+7H2SO4+6Fe+2SO4= Cr+32(SO4)3+3Fe+3(SO4)3+K2SO4+7H2O

2Cr6++6ē→Cr23+ 1 окислитель, процесс восстановления
Fe+2-ē→Fe+3 6 восстановитель, процесс окисления
Наблюдается окрашивание раствора в ярко-желтый.
Опыт 9 «Окислительные свойства перманганата калия»
А)
1)2KMn+7O4+8H2SO4+10KI=5I02+2Mn+2+6K2SO4+8H2O

Mn+7+5ē→Mn+2 2 окислитель, процесс восстановления
2I--2ē→I02 5 восстановитель, процесс окисления
Наблюдается окрашивание раствора в коричневый.
2) 2KMn+7O4+3H2SO4+5Na2S+4O3=2Mn+2SO4+5Na2S+6O4+ К2SO4+3H2O

Mn+7+5ē→Mn+2 2 окислитель, процесс восстановления
S+4-2ē→S+6 5 восстановитель, процесс окисления
В ходе реакции раствор обесцветился.
3) 2КMn+7O4+8H2SO4+10Fe+2SO4=2Mn+2SO4+5Fe+32(SO4)3+K2SO4+8H2O

Mn7++5ē→Mn2+ 2 окислитель, процесс восстановления
2Fe+2-2ē→2Fe+3 5 восстановитель, процесс окисления
Наблюдается окрашивание раствора в желтый.
Б)
1)2KMnO4+3Na2SO3+H2O=3Na2SO4+2KOH+2MnO2

Mn7++3ē→Mn4+ 2 окислитель, процесс восстановления
S+4-2ē→S+6 3 восстановитель, процесс окисления
Наблюдается изменение цвета раствора на желтый, образование коричневого осадка.
2)2KMnO4+3MnSO4+2H2O=5MnO2+K2SO4+2H2SO4

Mn7++3ē→Mn4+ 2 окислитель, процесс восстановления
Mn+2-2ē→Mn4+ 3 восстановитель, процесс окисления
Наблюдается изменение цвета раствора на зеленый.
В)
3)8KMnO4+KI+8KOH=8K2MnO4+KIO4+4H2O

Mn7++1ē→Mn6+ 8 окислитель, процесс восстановления
I-1 -8ē → I+7 1 восстановитель, процесс окисления
Наблюдается изменение цвета раствора на зеленый.
Вывод:
В ходе лабораторной работе я ознакомился с наиболее распространенными окислителями и восстановителями, продуктами их взаимодействия между собой и научилася составлять уравнения окислительно-восстановительных реакций.
Контрольная работа.
1)Какие реакции называют окислительно-восстановительными?
Окислительно-восстановительными называют реакции, протекающие с изменением степени окисления элементов.
2-3) В каком случае элемент является окислителем?В каком случае элемент является восстановителем?
Окислителем называют элемент, который в ходе реакции понижает степень окисления, а восстановителем – элемент, который повышает степень окисления. Элемент-окислитель при окислительно-восстановительной реакции восстанавливается (принимает электроны на валентную оболочку), а восстановитель окисляется (отдает электроны)
4) Что такое степень окисления?
Степень окисления – это гипотетический заряд, который имели бы атомы данного элемента, если бы соединение было построено из ионов.
5) Чему равна максимальная степень окисления элемента?
Высшая степень окисления элемента равна номеру группы периодической системы, в которой данный элемент расположен. Низшая отрицательная степень окисления для p-элементов 4 – 7 групп Периодической системы Д. И. Менделеева равна числу электронов, которое может принять данный элемент на застраивающийся np-подуровень: zmin = N – 8, где N – номер группы.
6) Как определить минимальную степень окисления элемента?
Низшая степень окисления равна числу, которое получится, если от номера группы элемента отнять 8.
Исключения: фтор, железо, кобальт, родий, подгруппа никеля, кислород, благородные газы (помимо ксенона)
7) Как определить степень окисления соединения в соединении?
Численно степень окисления равна количеству электронов, которые перешли от одного атома к другому. У атома с меньшей ЭО, который отдает электроны, — положительная степень окисления. У атома с большей ЭО, который притягивает электроны, — отрицательная степень окисления.
8) Как зависит состав продуктов восстановления перманганата калия в зависимости от рН среды?
Перманганат калия в разных средах восстанавливается до разных продуктов: в условиях кислой среды (pH<7) - до солей Mn2+; в условиях нейтральной среды (pH
7) - до MnO2; в условиях сильнощелочной среды (pH»7) - до манганата MnO42-.
9) Как зависит состав продуктов восстановления хрома (VI) от рН среды?
Окислительная способность хрома (VI) выше в кислой среде. Дихромат – сильный окислитель. Хромат – слабый окислитель, поэтому хром (VI) получают обычно окислением хрома (3+) в щелочной среде.
10) В какой степени окисления элементы обладают окислительно-восстановительной двойственностью?