Файл: Минобрнауки россии федеральное государственное бюджетное образовательное учреждение высшего образования Тульский государственный университет.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 11.12.2023
Просмотров: 30
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
·O2(г)=NO(г)
б) 4NH3(г)+5O2(г)=4NO(г)+6H2O(ж); ΔHх.р.1=−1168.80 кДж
4NH3(г)+3O2(г)=2N2(г)+6H2O(ж); ΔHх.р.2=−1530.28 кДж
Из первой реакции вычтем вторую, получим:
2О2+2N2=4NO(г)
В соответствии с законом Гесса ΔН3=ΔН1-ΔН2:
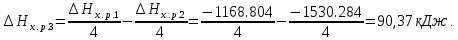
Ответ: 90,37 кДж.
Задание 8. Тепловой эффект реакции C + 2N2O = CO2 + 2N2 равен –560,0 кДж. Вычислите стандартную теплоту образования N2O.
Решение:
Согласно следствию из закона Гесса, тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции.
ΔНº = 2·ΔНº298(N2(г)) + ΔНº298(СО2(г)) - ΔНº298(С(тв)) - 2·ΔНº298(N2O(г)) = -560 кДж
Теплоты образования простых веществ равны нулю, а стандартная теплота образования ΔНº298(СО2(г)) = -393,513 кДж/моль. Тогда:
ΔНº298(N2O(г)) = (ΔНº298(СО2(г)) +560)/2 = (-393,513+560)/2= 83,2535 кДж/моль.
Ответ: 83,2535 кДж/моль.
Задание 9. Газофазная реакция SO2+1/2O2 ↔ SO3, являющаяся стадией получения серной кислоты, описывается кинетическим уравнением r=k[SO2][O2]. Как изменится скорость этой реакции, протекающей при соотношении реагентов [SO2]:[O
2]=2:1, если:
а) увеличить избыток SО2 по отношению к О2;
б) увеличить избыток О2 по отношению к стехиометрическому количеству О2?
Решение:
Частные порядки по реагентам SO2 и O2 одинаковы и равны 1. Можем предположить, что увеличение концентрации любого из реагентов одинаковым образом будет влиять на скорость реакции.
а) при увеличении избытка SO2 по отношению к O2 в Х раз скорость реакции будет равна:
V=k·(Х·[SO2])·[O2]=k·Х·[SO2]·[O2]=Х·r
Таким образом при увеличении избытка SO2 по отношению к O2 в Х раз скорость увеличится в Х раза.
б) при увеличении избытка O2 по отношению к стехиометрическому количеству O2 в Х раз скорость реакции станет равна:
V=k·[SO2]·[Х·O2]=k·Х·[SO2]·[O2] = Х·r
Таким образом при увеличении избытка O2 по отношению к стехиометрическому количеству O2 в Х раз скорость реакции увеличится в Х раз.
Задание 10. Реакция протекает по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были [N2] = 0,049 моль/л, [О2] = 0,01 моль/л. Вычислите концентрацию этих веществ, когда [NО] = 0,005 моль/л.
Решение:
При убыли из системы по 1 моль каждого из исходных веществ образуется 2 моль продукта реакции. В момент времени, когда концентрация NO станет равна 0,005 моль/л, концентрации азота и кислорода будут иметь следующие значения:
[N2]` = [N2] - [NO]/2 = 0,049 − 0,005/2=0,0465 моль/л
[O2]` = [O2]- [NO]/2 = 0,01 – 0,005/2=0,0075 моль/л
Ответ: при [NО] = 0,005 [N2]` = 0,0465 моль/л, [O2]` = 0,0075 моль/л.
б) 4NH3(г)+5O2(г)=4NO(г)+6H2O(ж); ΔHх.р.1=−1168.80 кДж
4NH3(г)+3O2(г)=2N2(г)+6H2O(ж); ΔHх.р.2=−1530.28 кДж
Из первой реакции вычтем вторую, получим:
2О2+2N2=4NO(г)
В соответствии с законом Гесса ΔН3=ΔН1-ΔН2:
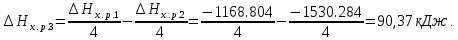
Ответ: 90,37 кДж.
Задание 8. Тепловой эффект реакции C + 2N2O = CO2 + 2N2 равен –560,0 кДж. Вычислите стандартную теплоту образования N2O.
Решение:
Согласно следствию из закона Гесса, тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции.
ΔНº = 2·ΔНº298(N2(г)) + ΔНº298(СО2(г)) - ΔНº298(С(тв)) - 2·ΔНº298(N2O(г)) = -560 кДж
Теплоты образования простых веществ равны нулю, а стандартная теплота образования ΔНº298(СО2(г)) = -393,513 кДж/моль. Тогда:
ΔНº298(N2O(г)) = (ΔНº298(СО2(г)) +560)/2 = (-393,513+560)/2= 83,2535 кДж/моль.
Ответ: 83,2535 кДж/моль.
Задание 9. Газофазная реакция SO2+1/2O2 ↔ SO3, являющаяся стадией получения серной кислоты, описывается кинетическим уравнением r=k[SO2][O2]. Как изменится скорость этой реакции, протекающей при соотношении реагентов [SO2]:[O
2]=2:1, если:
а) увеличить избыток SО2 по отношению к О2;
б) увеличить избыток О2 по отношению к стехиометрическому количеству О2?
Решение:
Частные порядки по реагентам SO2 и O2 одинаковы и равны 1. Можем предположить, что увеличение концентрации любого из реагентов одинаковым образом будет влиять на скорость реакции.
а) при увеличении избытка SO2 по отношению к O2 в Х раз скорость реакции будет равна:
V=k·(Х·[SO2])·[O2]=k·Х·[SO2]·[O2]=Х·r
Таким образом при увеличении избытка SO2 по отношению к O2 в Х раз скорость увеличится в Х раза.
б) при увеличении избытка O2 по отношению к стехиометрическому количеству O2 в Х раз скорость реакции станет равна:
V=k·[SO2]·[Х·O2]=k·Х·[SO2]·[O2] = Х·r
Таким образом при увеличении избытка O2 по отношению к стехиометрическому количеству O2 в Х раз скорость реакции увеличится в Х раз.
Задание 10. Реакция протекает по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были [N2] = 0,049 моль/л, [О2] = 0,01 моль/л. Вычислите концентрацию этих веществ, когда [NО] = 0,005 моль/л.
Решение:
При убыли из системы по 1 моль каждого из исходных веществ образуется 2 моль продукта реакции. В момент времени, когда концентрация NO станет равна 0,005 моль/л, концентрации азота и кислорода будут иметь следующие значения:
[N2]` = [N2] - [NO]/2 = 0,049 − 0,005/2=0,0465 моль/л
[O2]` = [O2]- [NO]/2 = 0,01 – 0,005/2=0,0075 моль/л
Ответ: при [NО] = 0,005 [N2]` = 0,0465 моль/л, [O2]` = 0,0075 моль/л.