Файл: 2. Физикохимические основы процесса получения битума Химия и механизм процесса.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 12.12.2023
Просмотров: 35
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
2. Физико-химические основы процесса получения битума
2.1. Химия и механизм процесса
Процесс окисления сопровождают не только реакции присоединения кислорода к атомам углерода, т.е. образование связей С-О или С-О-О-, но и реакции отщепления протонов Н, приводящие к реакциям конденсации органических молекул и образованию молекул воды. То есть происходит либо присоединение кислорода к молекулам сырья с образованием асфальтогеновых кислот, либо отщепление водорода с образованием более конденсированных соединений – САВ.
При окислении протекает множество реакций: окислительное дегидрирование, деалкилирование, окислительная полимеризация, поликонденсация, крекинг с последующим уплотнением его продуктов.
1) Окислительное дегидрирование – это отщепление атомов водорода в углеродной цепи при участии кислорода.
а) Окислительное дегидрирование алканов:
R – CH2 – СН3 + 0,5 О2 → R – CH= СН2 + Н2О
алкен
б) Окислительное дегидрирование алкенов:
R –СН2 – СН2 - CH = СН2 + 0,5 О2 → R – CH= СН - СН= СН2+ Н2О
алкадиен
в) Окислительное дегидрирование спиртов:
R – CH2 – OH + 0,5 О2 → R – C = O + H2O альдегид
│
H
R – CH – R1 + 0,5 O2 → R – C – R1 + Н2О кетон
│ ║
ОН О
г) Окислительное дегидрирование ароматических углеводородов с боковой цепью:
Ar – CH2 – СН3 + 0,5 О2 → Ar – CH= СН2 + Н2О
2) Деалкилирование – это замещение алкильной группы в молекуле органического соединения на атом водорода.
Деалкилирование проводят под действием кислот Льюиса, минеральных кислот, пиролизе или облучении.
Например, деалкилирование применяют для получения бензола из толуола и высших его гомологов:
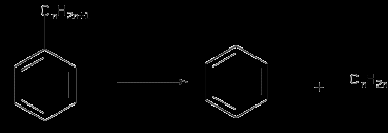
Деалкилирование гомологов бензола можно осуществить в присутствии водяного пара на никелевых или платиновых катализаторах при 350 -500оС.
3) Окислительная полимеризация происходит при образовании полимеров из непредельных органических соединений за счет поглощения ими кислорода.
Окислительная полимеризация протекает по радикальному механизму за счет образования пероксидных радикалов по месту разрыва π-связи:
●
R1 – CH = CH – R2 + O2 → R1 – CH – CH – R2
│
O
│
O●
Радикал соединяется с другой молекулой, инициируя полимеризацию:
●
R1 – CH – CH – R2 R1 – CH – CH – R2
│ │
O О
│ → │
O● О
+ │ ●
R1 – CH = CH – R2 R1 - CH – CH – R2
Образовавшиеся вновь активные центры являются началом появления новых поперечных связей, в результате образуется трехмерный полимер.
4) Поликонденсация – это процесс образования молекул полимеров за счет взаимодействия между функциональными группами одинаковых или различных молекул мономеров сопровождающийся выделением побочных низкомолекулярных продуктов (например, воды).
В качестве примера поликонденсации можно привести реакцию поликонденсации фенолов при образовании смол:

 …Ar – OH + Ar-OH + Ar-OH … → Ar - O – Ar – O – Ar… + nH2O
…Ar – OH + Ar-OH + Ar-OH … → Ar - O – Ar – O – Ar… + nH2On
5) Крекинг с последующим уплотнением его продуктов.
Термический крекинг – процесс переработки нефтяных фракций путем их термического разложения с целью получения дополнительного количества светлых нефтепродуктов (бензина), крекинг-остатка для производства игольного кокса и термогазойля для производства сажи.
Для крекинга парафинов характерен распад на более низкомолекулярные углеводороды:
С8Н18 → С4Н10 + С4Н8
октан бутан бутен
Бициклические нафтены при крекинге дают ароматические углеводороды, моноциклические нафтеновые углеводороды, алифатические углеводороды:
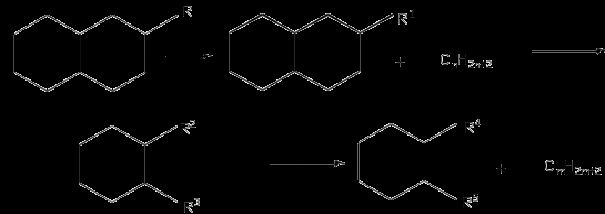
Бензол при крекинге переходит в дифенил с выделением водорода:
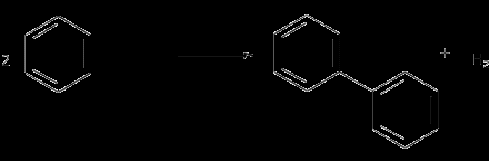
При термокрекинге, наряду с реакциями разложения, в результате которых получаются бензин и газ, протекают реакции уплотнения образовавшихся продуктов, в результате которых получается кокс и крекинг-остаток.
Основная часть кислорода воздуха идет на образование воды и углекислого газа, незначительная часть – на образование органических веществ, содержащих кислород.
Реакция окисления нефтяных остатков сильно экзотермическая, тепловой эффект, который составляет 200 – 1000 кДж/кг [17].





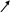







Гидроксикислоты
Асфальтогеновые кислоты
Карбены
Асфальтены
Смолы
Кислоты
Углеводороды
Черножуков и Крейн [15] указали, что окисление, в зависимости от условий, может идти в двух направлениях:

Карбоиды
1) При жидкофазном окислении углеводородов в условиях относительно низких температур молекулярный кислород присоединяется только по связям С – Н, поэтому получение кислот протекает через промежуточную стадию образования гидроперекисей.
СН3 СН3
│ │
R1 –CH2 – CH2 – C – CH2 – R2 + O2 → R1 –CH2 – CH2 – C – CH2 – R2
│ │
H O – O – H
СН3 СН3
│ │
R1 –CH2 – CH2 – C – CH2 – R2 + O2 → R1 –CH2 – CH – C – CH2 – R2
│ │ │
O –O-H OO – H O –O –H
Появление двух гидроперекисных групп у соседних атомов углерода приводит к разрыву связи С-С. В присутствии кислорода в результате распада двухатомных гидроперекисей образуются кислоты:
R1 –CH2 – CH – CH – CH2 – R2 + ½ O2 → R1-CH2-COOH + R2 –CH2-COOH
│ │ - H2O
O –O-H O –O –H
2) При действии кислорода на образовавшиеся кислоты образуется новая гидроперекись с последующим ее разложением и образованием оксокислот:
R – CH2 – CH2 – COOH + O2 → R – CH – CH2 – COOH →
│
O – O –H
→ R – CH – CH
2 – COOH + [O]
│
OH
Распад одноатомных гидроперекисей может происходить как при термическом воздействии, так и в присутствии кислорода и катализаторов.
3) Оксикислоты образуют эстолиды:
НО – R- COOH + HO – R1 –COOH → HO – R –OCO –R1- COOH + H2O
Эстолид представляет собой сложный эфир, который может снова вступать в реакцию с молекулой оксикислоты и т.д. В результате реакции поликонденсации образуются асфальтеновые кислоты, представляющие собой полимерные молекулы сложного строения.
II) Углеводороды → Смолы → Асфальтены → Карбоиды
1) При окислении алкилароматических углеводородов образуются гидроперекиси, которые при распаде дают фенолы и кетоны.
R1 R1
│ │
R2 – C - H + O2 → R2 – C – O – O –H → Ar – OH + R1 – C – R2
│ │ ║
Ar Ar O
Образующиеся фенолы и кетоны вступают в реакции поликонденсации с образованием смол:


…Ar – OH + Ar-OH + Ar-OH … → Ar - O – Ar – O – Ar… + nH2O
n
2) При термополиконденсации смол происходит образование асфальтенов. Превращение смол в асфальтены происходит при нагревании до 300—350 °С, при условии, что в нефтяном растворе содержится не менее 20—25% смол.
Основная ячейка асфальтенов – поликонденсированные полиароматические слои, которые налагаются один на другой и соединяются посредством межмолекулярных связей, образуя межмолекулярные или внутримолекулярные ассоциации. Несколько таких ассоциаций могут образовывать агрегаты, или мицеллы, разных размеров.
Схематическое строение асфальтенов:
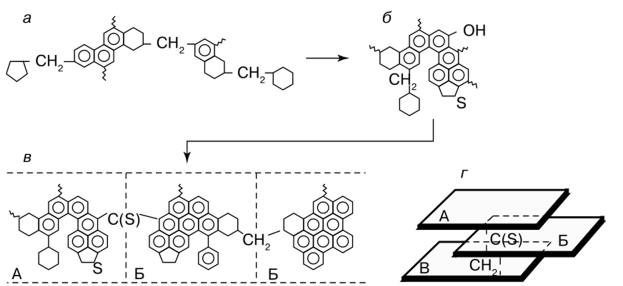
Рисунок 2.1 Модели строения молекул смол и асфальтенов и их генетической связи.
а) углеводороды; б) смолы; в) асфальтены; г) модель внутримолекулярной упаковки асфальтенов.
3) Карбоиды – это нерастворимая в органических растворителях часть твердых углеродистых веществ. Они имеют разный состав и разное происхождение. При длительном нагревании до 450оС и выше значительная часть асфальтенов путем дегидратации и уплотнения переходит в карбоиды.
Механизм процесса
Процесс окисления сырья до битума протекает по радикально цепному механизму и представляет собой гетерогенную реакцию между газовой и жидкой фазами.
Кислород воздуха реагирует с водородом, содержащемся в сырье, образуя водяные пары. Потеря водорода сопровождается процессами уплотнения с образованием высокомолекулярных продуктов большой степени ароматичности - асфальтенов. В результате изменяется консистенция битума. Основная часть кислорода воздуха идет на образование воды, (10…20) % - на образование углекислого газа и лишь незначительная часть - на образование органических веществ, содержащих кислород.
Основное количество кислорода, подаваемого на окисление, уносится с отходящими газами. Процесс окисления носит дегидрогенизационный характер.
Количество химически связанного кислорода в окисленном битуме увеличивается с повышением содержания ароматических углеводородов в сырье - нефтяном остатке.
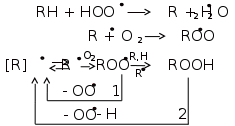
Рисунок 2.2 Механизм процесса окисления.
2.2. Кинетика и термодинамические характеристики основной реакции
Модельной реакцией процесса является реакция окисления толуола с дальнейшим получением бензойной кислоты:
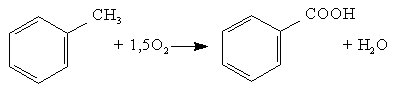
В результате термодинамического анализа основной реакции, можно сделать следующие выводы:
-
Значение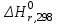 < 0, реакция протекает с выделением теплоты, процесс реакции – экзотермический.
< 0, реакция протекает с выделением теплоты, процесс реакции – экзотермический. -
При повышении температуры величины константы равновесия уменьшаются, следовательно, есть тенденция смещения равновесия в сторону исходных веществ. -
При стандартных условиях свободная энергия Гиббса ∆G°298 < 0, химическая реакция в этих условиях протекает в прямом направлении. Самопроизвольное протекание реакции возможно при отрицательной энергии Гиббса. Т. к. ∆G°298 < 0 можно сделать вывод, что происходит самопроизвольное протекание реакции. -
Высокие значения константы равновесия реакции свидетельствуют о том, что реакция необратима.
Процесс окисления сырья до битума представляет собой гетерогенную реакцию между газовой и жидкой фазами.
Кислород воздуха реагирует с водородом, содержащемся в сырье, образуя водяные пары. Потеря водорода сопровождается процессами уплотнения с образованием высокомолекулярных продуктов большой степени ароматичности - асфальтенов. В результате изменяется консистенция битума. Основная часть кислорода воздуха идет на образование воды, (10…20) % - на образование углекислого газа и лишь незначительная часть - на образование органических веществ, содержащих кислород.