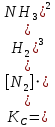ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 10.01.2024
Просмотров: 56
Скачиваний: 7
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
 МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИфедеральное государственное бюджетное образовательное учреждение высшего образования
«Тольяттинский государственный университет»
| (наименование института полностью) |
| Архитектурно–строительный институт |
| (Наименование учебного стуктурного подразделения) |
| 08.03.01 Строительство |
| (код и наименование направления подготовки / специальности) |
| Промышленное и гражданское строительство |
| (направленность (профиль) / специализация) |
Практическое задание №___
по учебному курсу « Химия »
(наименование учебного курса)
Вариант 9 (при наличии)
| Обучающегося | Т.Р. Кондратов | |
| | (И.О. Фамилия) | |
| Группа | СТРбд-2003в | |
| | | |
| Преподаватель | О.С. Авдякова | |
| | (И.О. Фамилия) | |
Тольятти 2023
Задача 1
Рассчитать массу оксида ртути (II), если при разложении этого вещества выделилось 1,8 л кислорода при температуре 350º С и давлении 745 мм рт. ст.
Решение:
Реакция разложения оксида ртути (II) описывается уравнением:
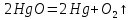
Из уравнения Менделеева-Клапейрона:
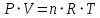
Где Р – давление в кПа, V – объем в л, n –количество вещества в моль,
R- универсальная газовая постоянная, Дж/Моль·К, Т – температура в К
Находим количество вещества кислорода:
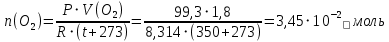
При разложении 2 моль оксида ртути (II) образуется 1 моль кислорода, т.е. n(HgO) = 2n(O2) = 2·3,45·10-2 = 6,9·10-2 моль
Находим массу оксида ртути (II):
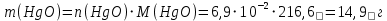
Задача 2
Сколько металла, молярная масса эквивалента которого 12,16 г/моль, прореагирует с 370 мл кислорода (Р = 700 мм рт. ст., t = 100º С)?
Решение:
Уравнение Менделеева-Клапейрона:

Где Р – давление в кПа, V – объем в л, n –количество вещества в моль,
R- универсальная газовая постоянная, Дж/Моль·К, Т – температура в К
Находим количество вещества кислорода:
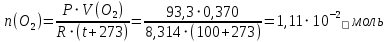
Находим массу кислорода:
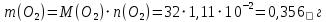
Из закона эквивалентов:
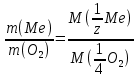
выражаем массу металла:
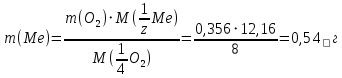
Задача 3
По порядковому номеру элемента составить электронную формулу его атома. Определить природу элемента и валентные электроны. Указать квантовые числа для трех последних электронов. Охарактеризовать местоположение в периодической таблице Д. И. Менделеева. Сравнить электроотрицательности, атомные радиусы и энергии ионизации между элементом и соседними элементами в группе и периоде. Определить состав атома (количество электронов, протонов и нейтронов).
Элементы № 85, 41
Решение:
Элемент с порядковым номером 85 – астат At.
Он расположен в 6 периоде, в VII группе, главной подгруппе периодической таблицы Д. И. Менделеева.
Электронная формула атома астата:
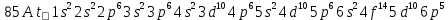
Астат относится к типичным неметаллам.
Валентные электроны
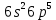 .
.Квантовые числа для трех последних электронов атома астата
| | n | l | ml | ms |
| 6p3 | 6 | 1 | -1 | – ½ |
| 6p4 | 6 | 1 | 0 | – ½ |
| 6p5 | 6 | 1 | 1 | – ½ |
Электроотрицательность астата больше электроотрицательности полония.
Астат имеет минимальную электроотрицательность в своей подгруппе.
Астат имеет максимальный атомный радиус в своей подгруппе.
Астат имеет минимальную энергию ионизации в своей подгруппе.
В атоме астата 85 протонов, 85 электронов и 125 нейтронов (для наиболее стабильного изотопа
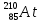 ).
).Элемент с порядковым номером 41 – ниобий Nb.
Ниобий расположен в 5 периоде, в V группе, побочной подгруппе периодической таблицы Д. И. Менделеева.
Электронная формула атома ниобия:
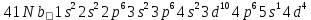
Ниобий относится к амфотерным элементам.
Квантовые числа для трех последних электронов атома ниобия
| | n | l | ml | ms |
| 4d2 | 4 | 2 | -1 | + ½ |
| 4d3 | 4 | 2 | 0 | + ½ |
| 4d4 | 4 | 2 | 1 | + ½ |
Электроотрицательность ниобия больше электроотрицательности циркония и тантала, но меньше электроотрицательности молибдена и ванадия.
Атомный радиус ниобия меньше атомного радиуса циркония и тантала, но больше атомного радиуса молибдена и ванадия.
Атомный радиус ниобия меньше атомного радиуса полония, но больше атомного радиуса радона.
Энергия ионизации ниобия больше энергии ионизации циркония тантала, но меньше энергии ионизации молибдена и ванадия.
Энергия ионизации ниобия больше энергии ионизации полония.
В атоме ниобия 41 протон, 41 электрон и 51 нейтрон (для изотопа
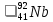 ).
).Задача 4
При окислении 10 г алюминия выделится 309,6 кДж теплоты. Вычислить энтальпию образования оксида алюминия.
Решение:
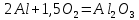
1 моль оксида алюминия образуется при окислении 2 моль алюминия.
Молярная масса алюминия равна
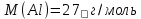
Находим тепловой эффект реакции
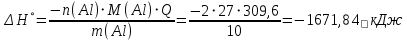
Согласно следствию из закона Гесса тепловой эффект реакции равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ, с учетом коэффициентов перед формулами веществ уравнении реакции.
Находим энтальпию образования оксида алюминия:
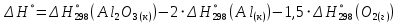
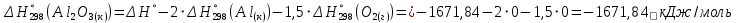
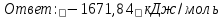
Задача 5
Рассчитать изменение стандартной свободной энергии Гиббса и сделать вывод о направлении процесса при указанной температуре. Рассчитать температуру равной вероятности прямого и обратного процессов. Сделать вывод о направлении процесса выше и ниже этой температуры.
СН4(г) + Н2О(г) ↔ СО(г) + Н2(г); 850º С
Решение:
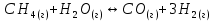
Изменение энтальпии реакции:
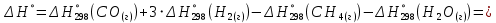
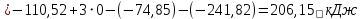
Изменение энтропии реакции:
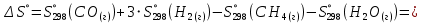
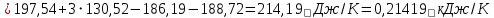
Связь между абсолютной температурой и температурой по шкале Цельсия
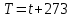
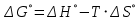
Находим изменение энергии Гиббса при 25 ºС:
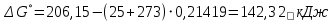
Находим изменение энергии Гиббса при 850 ºС
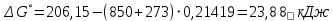
Делаем вывод, что при и 25 ºС и при 850 ºС реакция протекает в обратном направлении (влево).
Энтальпийный фактор не благоприятствует протеканию реакции в прямом направлении, энтропийный – благоприятствует протеканию реакции в прямом направлении.
Находим температуру начала реакции
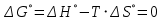
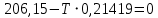
Отсюда,
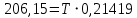
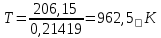
Ниже данной температуры процесс идет в обратную сторону (влево), при данной температуре (и выше) процесс идет вправо.
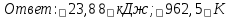
Задача 6
В газофазной реакции N2 + Н2 ↔ NН3 начальные концентрации азота и водорода составляли 6 и 11,2 моль/л, соответственно. Рассчитать константу равновесия реакции, если к моменту равновесия прореагировало 40 % исходного количества азота.
Решение:
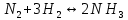
Согласно уравнению реакции при вступлении в реакцию 1 моль азота и 3 моль водорода образуется 2 моль аммиака.
Находим равновесные концентрации веществ в смеси:
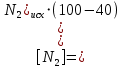
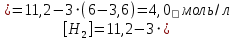
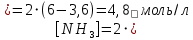
Находим константу равновесия: