Файл: Учебнометодическое пособие Тюмень, 2018 удк 54 н 24. 1 Рецензенты.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 11.01.2024
Просмотров: 284
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Li2O - оксид лития, N2O5- оксид азота
Классификация оксидов:
По химическим свойствам оксиды подразделяют на солеобразующие и несолеобразующие. Несолеобразующих оксидов немного: NO, CO. Солеобразующие оксиды подразделяют на основные, кислотные и амфотерные.
Основные оксиды – это оксиды, которым соответствуют основания.
Например: CaO- Ca(OH)2
Оксиды щелочных и щелочно-земельных металлов при взаимодействии с водой образуют щелочи.
Например: CaO+ H2O═Ca(OH)2
Основные оксиды взаимодействуют с кислотами, образуя соль и воду.
ZnO + 2HCl = ZnCl2 + Н2O
Кислотные оксиды – это такие оксиды, которым соответствуют кислоты. Например:
SO3- H2SO4
Кислотные оксиды образуются неметаллами и некоторыми металлами, проявляющими высокие степени окисления (CrO3- H2CrO4)
Большинство кислотных оксидов реагирует с водой с образованием кислоты.
SO3 +H2O=H2SO4
Cl2O7 + H2O = 2HClO4
Кислотные оксиды реагируют с основаниями с образованием соли и воды.
SO2 +2NaOH=Na2SO3 +H2O
P2O5 + 6KOH = 2K3PO4 + 3H2O
Амфотерные оксиды – это оксиды, которые в зависимости от условий проявляют основные или кислотные свойства. ( Al2O3 , ZnO, Cr2O3)
Амфотерные оксиды с водой непосредственно не соединяются, но они реагируют с кислотами и с основаниями.
Al2O3 +6HCl=2AlCl3 +3H2O
ZnO + H2SO4 = ZnSO4 + H2O
ZnO + 2KOH = K2ZnO2 + H2O (Правильнее: ZnO + 2KOH + H2O = K2[Zn(OH)4])
Al2O3 + 2NaOH = 2NaAlO2 + H2O (Правильнее: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4])
Получение оксидов:
a) окислением элементов кислородом
4Al + 3O2 = 2Al2O3;
S + O2 = SO2;
б) при разложении сложных веществ
Ca(OH)2 → CaO + H2O
H2SO3 → SO2 + H2O;
в) при окислении сложных веществ
2H2S + 3O2 →2SO2 + 2H2O
2.2. Основания
Основания – это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксильных групп.
Количество гидроксильных групп определяет его кислотность. Например, однокислотное основание – NaOH, двухкислотное основание – Ba(OH)2.
Классификация оснований:
По растворимости в воде основания делят на растворимые (щелочи) и нерастворимые. К щелочам относят гидроксиды щелочных и щелочно-земельных металлов (NaOH, Ba(OH)
2).
Способы получения:
1. Реакции активных металлов (щелочных и щелочноземельных металлов) с водой:
2Na + 2H2O→2NaOH + H2
Ca + 2H2O →Ca(OH)2 + H2
2. Взаимодействие оксидов активных металлов с водой:
BaO + H2O→ Ba(OH)2
3. Электролиз водных растворов солей
2NaCl + 2H2O → 2NaOH + H2 + Cl2
Химические свойства:
1. Основания реагируют с кислотами с образованием соли и воды:
3KOH+H3PO4 =K3PO4 +3H2O
Bа(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
2. Щелочи взаимодействуют с кислотными оксидами и различными солями:
Ba(OH)2 +N2O5 =Ba(NO3)2 +H2O
2NaOH + CO2 = Na2СO3 + H2O
Ca(OH)2 + Cu(NO3)2 = Cu(OH)2 + Ca(NO3)2
3.Нерастворимые основания при нагревании разлагаются на оксид и воду:
Cu(OH)2 →CuO + H2O
4. Амфотерные основания (Al(OH)3, Zn(OH)2) взаимодействуют со щелочами:
Al(OH)3 + NaOH = Na[Al(OH)4]
5.Амфотерные основания реагируют с кислотами, проявляют при этом основные свойства:
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
2.3. Кислоты
Кислоты – это сложные вещества, состояшие из атомов водорода и кислотных остатков.
Классификация кислот:
Кислоты классифицируют по составу, основности и силе.
По химическому составу различают кислоты кислородсодержащие(H2SO4, HNO3) и бескислородные (HCl,H2S).
По основности (по числу атомов водорода, способных замещаться на металл) кислоты делятся на
Одноосновные (HNO3, HCl)
Двухосновные (H2SO4)
Трехосновные (H3PO4)
Получение кислот
1.Взаимодействие кислотных оксидов с водой:
SO3 +H2O=H2SO4
2.Взаимодействие кислот с солями (взятая кислота должна быть более сильной, чем получаемая):
NaCI + H2SO4→HCI+ NaHSO4
3.Взаимодействие неметаллов с водородом:
H2+CI2→2HCI
Химические свойства
1.Кислоты взаимодействуют с металлами, находящимися в ряду напряжений левее водорода с образованием соли и водорода:
2HCl+Zn=ZnCl2 +H2
H2SO4 (разб.)+Fe=FeSO4 +H2
Важно: кислоты-окислители (HNO3, конц. H2SO4) реагируют с металлами по-другому.
2.Кислоты взаимодействуют с основными и амфотерными оксидами:
2HNO3 + CuO = Cu(NO3)2 + H2O
3H2SO4 + Fe2O3 = Fe2(SO4)3 + 3H2O
3H2SO4 + Cr2O3 = Cr2(SO4)3 + 3H2O
2HBr + ZnO = ZnBr2 + H2O
3.Кислоты реагируют с основаниями с образованием соли и воды:
H2SiO3 +2KOH=K2SiO3 +2H2O
2HBr + Ni(OH)2 = NiBr2 + 2H2O
2.4. Соли
Соли могут состоять из ионов металла кислотного остатка. Соли являются продуктами как полного, так и частичного замещения атомов водорода в молекуле кислоты на металл или замещения гидроксогруппы на кислотный остаток.
Классификация солей:
Все соли разделяются насредние, кислыеи основные. Средние соли содержат только атомы металла и кислотного остатка.
Кислые соли образуются многоосновными кислотами. Одноосновные кислоты кислых солей не образуют. Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода.
Названия кислых солей содержат приставку "гидро". Например:
NaHCO3 – гидрокарбонат натрия,
K2HPO4 – гидрофосфат калия,
KH2PO4 – дигидрофосфат калия.
Основные соли образуются при неполной нейтрализации основания. Названия основных солей образуют с помощью приставки "гидроксо".
Mg(OH)Cl- гидросохлорид магния.
Основные соли, помимо ионов металла и кислотного остатка, содержат гидроксильные группы. Основные соли образуются только из многокислотных оснований.
Химические свойства
1.Соли взаимодействуют с металлами, причем в ряду стандартных электродных потенциалов каждый предыдущий металл вытесняет последующие из растворов их солей:
FeSO4+Zn→ZnSO4+Fe
2.Соли взаимодействуют друг с другом:
CuSO4+BaCl2→CuCl2+BaSO4↓
3.Соли взаимодействуют со щелочами:
CuSO4+2NaOH →Cu(OH)2↓+2Na2SO4
4.Соли при нагревании разлагаются:
СаСO3 →СаО+СO2
Пример: Составить формулы всех возможных солей, образуемых Fe(OH)3 и H3PO4. Привести их названия.
Поскольку соль образуется соединением двух остатков (кислоты и основания), то целесообразно использовать заряды этих остатков целиком, а не рассматривать отдельные элементы. Тогда задача сводится просто к подбору в молекулах индексов, обеспечивающих электронейтральность. Фосфорная кислота способна дать три остатка H
2PO4,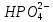 и
и 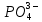 (их отрицательные заряды удобно подсчитывать по числу положительных ионов водорода, отщепившихся от нейтральной молекулы (H3PO4). Электронейтральность молекул, образованных этими остатками с Fe3+, обеспечивается соответствующими индексами в формулах.
(их отрицательные заряды удобно подсчитывать по числу положительных ионов водорода, отщепившихся от нейтральной молекулы (H3PO4). Электронейтральность молекул, образованных этими остатками с Fe3+, обеспечивается соответствующими индексами в формулах.
Fe3+(H2PO4)3;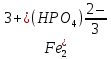 и
и 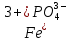
Гидроксид железа (III) способен дать три остатка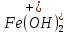 , FeOH2+ и Fe3+ (их положительные заряды удобно подсчитывать по числу отрицательных ионов гидроксида (OH–), отщепившихся от нейтральной молекулы Fe(OH)3. Электронейтральность молекул, образованных этими остатками с
, FeOH2+ и Fe3+ (их положительные заряды удобно подсчитывать по числу отрицательных ионов гидроксида (OH–), отщепившихся от нейтральной молекулы Fe(OH)3. Электронейтральность молекул, образованных этими остатками с 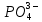 , обеспечивается соответствующими индексами в формулах:
, обеспечивается соответствующими индексами в формулах:
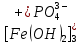 ,
, 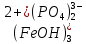 ,
, 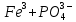
Последняя формула совпадает с ранее полученной в предыдущем ряду.
В соответствии с приложением 1, составляем названия полученных солей:
FeOP4 фосфат железа
Fe2(HPO4)3 гидрофосфат железа
Fe(H2PO4)3 дигидрофосфат железа
(FeOH)3(PO4)2 гидроксофосфат железа
[Fe(OH)2]3PO4 дигидроксофосфат железа
2.5. Вопросы для самоконтроля:
1.Перечислите классы неорганических соединений.
2.Оксиды, классификация и свойства.
3.Кислоты, классификация и свойства.
4.Соли, классификация и свойства.
5.Основания, классификация и свойства.
2.6. Контрольные задания
11-20. Составьте формулы всех солей, соответствующих кислотам и основаниям, приведенным для вашего задания в таблице 3. Для амфотерных гидроксидов необходимо составить формулы их солей, образованных как при реакциях с кислотами, так и с основаниями. Приведите реакцию получения одной из солей в молекулярной и ионной форме.
При написании уравнений руководствоваться таблицей растворимости и таблицей степеней диссоциации.
Таблица 3
Классификация оксидов:
По химическим свойствам оксиды подразделяют на солеобразующие и несолеобразующие. Несолеобразующих оксидов немного: NO, CO. Солеобразующие оксиды подразделяют на основные, кислотные и амфотерные.
Основные оксиды – это оксиды, которым соответствуют основания.
Например: CaO- Ca(OH)2
Оксиды щелочных и щелочно-земельных металлов при взаимодействии с водой образуют щелочи.
Например: CaO+ H2O═Ca(OH)2
Основные оксиды взаимодействуют с кислотами, образуя соль и воду.
ZnO + 2HCl = ZnCl2 + Н2O
Кислотные оксиды – это такие оксиды, которым соответствуют кислоты. Например:
SO3- H2SO4
Кислотные оксиды образуются неметаллами и некоторыми металлами, проявляющими высокие степени окисления (CrO3- H2CrO4)
Большинство кислотных оксидов реагирует с водой с образованием кислоты.
SO3 +H2O=H2SO4
Cl2O7 + H2O = 2HClO4
Кислотные оксиды реагируют с основаниями с образованием соли и воды.
SO2 +2NaOH=Na2SO3 +H2O
P2O5 + 6KOH = 2K3PO4 + 3H2O
Амфотерные оксиды – это оксиды, которые в зависимости от условий проявляют основные или кислотные свойства. ( Al2O3 , ZnO, Cr2O3)
Амфотерные оксиды с водой непосредственно не соединяются, но они реагируют с кислотами и с основаниями.
Al2O3 +6HCl=2AlCl3 +3H2O
ZnO + H2SO4 = ZnSO4 + H2O
ZnO + 2KOH = K2ZnO2 + H2O (Правильнее: ZnO + 2KOH + H2O = K2[Zn(OH)4])
Al2O3 + 2NaOH = 2NaAlO2 + H2O (Правильнее: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4])
Получение оксидов:
a) окислением элементов кислородом
4Al + 3O2 = 2Al2O3;
S + O2 = SO2;
б) при разложении сложных веществ
Ca(OH)2 → CaO + H2O
H2SO3 → SO2 + H2O;
в) при окислении сложных веществ
2H2S + 3O2 →2SO2 + 2H2O
2.2. Основания
Основания – это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксильных групп.
Количество гидроксильных групп определяет его кислотность. Например, однокислотное основание – NaOH, двухкислотное основание – Ba(OH)2.
Классификация оснований:
По растворимости в воде основания делят на растворимые (щелочи) и нерастворимые. К щелочам относят гидроксиды щелочных и щелочно-земельных металлов (NaOH, Ba(OH)
2).
Способы получения:
1. Реакции активных металлов (щелочных и щелочноземельных металлов) с водой:
2Na + 2H2O→2NaOH + H2
Ca + 2H2O →Ca(OH)2 + H2
2. Взаимодействие оксидов активных металлов с водой:
BaO + H2O→ Ba(OH)2
3. Электролиз водных растворов солей
2NaCl + 2H2O → 2NaOH + H2 + Cl2
Химические свойства:
1. Основания реагируют с кислотами с образованием соли и воды:
3KOH+H3PO4 =K3PO4 +3H2O
Bа(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
2. Щелочи взаимодействуют с кислотными оксидами и различными солями:
Ba(OH)2 +N2O5 =Ba(NO3)2 +H2O
2NaOH + CO2 = Na2СO3 + H2O
Ca(OH)2 + Cu(NO3)2 = Cu(OH)2 + Ca(NO3)2
3.Нерастворимые основания при нагревании разлагаются на оксид и воду:
Cu(OH)2 →CuO + H2O
4. Амфотерные основания (Al(OH)3, Zn(OH)2) взаимодействуют со щелочами:
Al(OH)3 + NaOH = Na[Al(OH)4]
5.Амфотерные основания реагируют с кислотами, проявляют при этом основные свойства:
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
2.3. Кислоты
Кислоты – это сложные вещества, состояшие из атомов водорода и кислотных остатков.
Классификация кислот:
Кислоты классифицируют по составу, основности и силе.
По химическому составу различают кислоты кислородсодержащие(H2SO4, HNO3) и бескислородные (HCl,H2S).
По основности (по числу атомов водорода, способных замещаться на металл) кислоты делятся на
Одноосновные (HNO3, HCl)
Двухосновные (H2SO4)
Трехосновные (H3PO4)
Получение кислот
1.Взаимодействие кислотных оксидов с водой:
SO3 +H2O=H2SO4
2.Взаимодействие кислот с солями (взятая кислота должна быть более сильной, чем получаемая):
NaCI + H2SO4→HCI+ NaHSO4
3.Взаимодействие неметаллов с водородом:
H2+CI2→2HCI
Химические свойства
1.Кислоты взаимодействуют с металлами, находящимися в ряду напряжений левее водорода с образованием соли и водорода:
2HCl+Zn=ZnCl2 +H2
H2SO4 (разб.)+Fe=FeSO4 +H2
Важно: кислоты-окислители (HNO3, конц. H2SO4) реагируют с металлами по-другому.
2.Кислоты взаимодействуют с основными и амфотерными оксидами:
2HNO3 + CuO = Cu(NO3)2 + H2O
3H2SO4 + Fe2O3 = Fe2(SO4)3 + 3H2O
3H2SO4 + Cr2O3 = Cr2(SO4)3 + 3H2O
2HBr + ZnO = ZnBr2 + H2O
3.Кислоты реагируют с основаниями с образованием соли и воды:
H2SiO3 +2KOH=K2SiO3 +2H2O
2HBr + Ni(OH)2 = NiBr2 + 2H2O
2.4. Соли
Соли могут состоять из ионов металла кислотного остатка. Соли являются продуктами как полного, так и частичного замещения атомов водорода в молекуле кислоты на металл или замещения гидроксогруппы на кислотный остаток.
Классификация солей:
Все соли разделяются насредние, кислыеи основные. Средние соли содержат только атомы металла и кислотного остатка.
Кислые соли образуются многоосновными кислотами. Одноосновные кислоты кислых солей не образуют. Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода.
Названия кислых солей содержат приставку "гидро". Например:
NaHCO3 – гидрокарбонат натрия,
K2HPO4 – гидрофосфат калия,
KH2PO4 – дигидрофосфат калия.
Основные соли образуются при неполной нейтрализации основания. Названия основных солей образуют с помощью приставки "гидроксо".
Mg(OH)Cl- гидросохлорид магния.
Основные соли, помимо ионов металла и кислотного остатка, содержат гидроксильные группы. Основные соли образуются только из многокислотных оснований.
Химические свойства
1.Соли взаимодействуют с металлами, причем в ряду стандартных электродных потенциалов каждый предыдущий металл вытесняет последующие из растворов их солей:
FeSO4+Zn→ZnSO4+Fe
2.Соли взаимодействуют друг с другом:
CuSO4+BaCl2→CuCl2+BaSO4↓
3.Соли взаимодействуют со щелочами:
CuSO4+2NaOH →Cu(OH)2↓+2Na2SO4
4.Соли при нагревании разлагаются:
СаСO3 →СаО+СO2
Пример: Составить формулы всех возможных солей, образуемых Fe(OH)3 и H3PO4. Привести их названия.
Поскольку соль образуется соединением двух остатков (кислоты и основания), то целесообразно использовать заряды этих остатков целиком, а не рассматривать отдельные элементы. Тогда задача сводится просто к подбору в молекулах индексов, обеспечивающих электронейтральность. Фосфорная кислота способна дать три остатка H
2PO4,
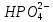 и
и 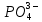 (их отрицательные заряды удобно подсчитывать по числу положительных ионов водорода, отщепившихся от нейтральной молекулы (H3PO4). Электронейтральность молекул, образованных этими остатками с Fe3+, обеспечивается соответствующими индексами в формулах.
(их отрицательные заряды удобно подсчитывать по числу положительных ионов водорода, отщепившихся от нейтральной молекулы (H3PO4). Электронейтральность молекул, образованных этими остатками с Fe3+, обеспечивается соответствующими индексами в формулах.Fe3+(H2PO4)3;
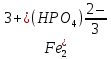 и
и 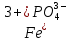
Гидроксид железа (III) способен дать три остатка
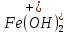 , FeOH2+ и Fe3+ (их положительные заряды удобно подсчитывать по числу отрицательных ионов гидроксида (OH–), отщепившихся от нейтральной молекулы Fe(OH)3. Электронейтральность молекул, образованных этими остатками с
, FeOH2+ и Fe3+ (их положительные заряды удобно подсчитывать по числу отрицательных ионов гидроксида (OH–), отщепившихся от нейтральной молекулы Fe(OH)3. Электронейтральность молекул, образованных этими остатками с 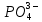 , обеспечивается соответствующими индексами в формулах:
, обеспечивается соответствующими индексами в формулах: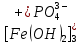 ,
, 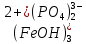 ,
, 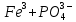
Последняя формула совпадает с ранее полученной в предыдущем ряду.
В соответствии с приложением 1, составляем названия полученных солей:
FeOP4 фосфат железа
Fe2(HPO4)3 гидрофосфат железа
Fe(H2PO4)3 дигидрофосфат железа
(FeOH)3(PO4)2 гидроксофосфат железа
[Fe(OH)2]3PO4 дигидроксофосфат железа
2.5. Вопросы для самоконтроля:
1.Перечислите классы неорганических соединений.
2.Оксиды, классификация и свойства.
3.Кислоты, классификация и свойства.
4.Соли, классификация и свойства.
5.Основания, классификация и свойства.
2.6. Контрольные задания
11-20. Составьте формулы всех солей, соответствующих кислотам и основаниям, приведенным для вашего задания в таблице 3. Для амфотерных гидроксидов необходимо составить формулы их солей, образованных как при реакциях с кислотами, так и с основаниями. Приведите реакцию получения одной из солей в молекулярной и ионной форме.
При написании уравнений руководствоваться таблицей растворимости и таблицей степеней диссоциации.
Таблица 3
| № задания | Исходные вещества | |||
| 1 | 2 | |||
| 11 | KOH | Zn(OH)2 | HClO4 | H3BO3 |
| 12 | CsOH | Fe(OH)3 | HClO3 | H2S |
| 13 | NaOH | Mg(OH)2 | H2SO3 | H3AsO4 |
| 14 | NH3OH | Cu(OH)2 | H2CO3 | H2SeO4 |
| 15 | LiOH | Al(OH)3 | HBr | H2TeO4 |
| 16 | Sr(OH)2 | Fe(OH)3 | HCl | H2SiO3 |
| 17 | Ba(OH)2 | Ni(OH)3 | HClO | H2CO3 |
| 18 | Ca(OH)2 | Co(OH)3 | HNO2 | H2S2O3 |
| 19 | Fe(OH)2 | Ca(OH)2 | HNO3 | H3PO4 |
| 20 | Ca(OH)2 | KOH | HClO3 | H2SO4 |