ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 11.01.2024
Просмотров: 61
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
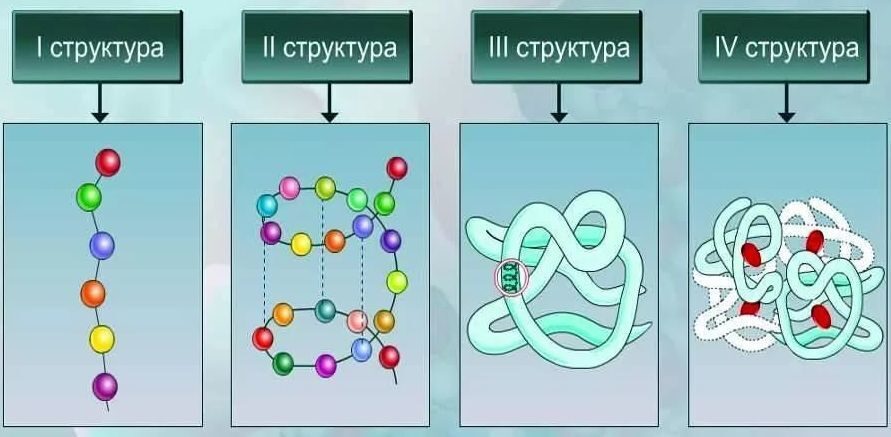
Рис. 8. Структурная организация белков
НЕСТАНДАРТНЫЕ АМИНОКИСЛОТЫ
(Не-протеиногенные)
Помимо стандартных аминокислот существует множество других аминокислот, которые называются не-протеиногенными или нестандартными. Такие аминокислоты либо не встречаются в белках (например, L-карнитин, ГАМК), либо не производятся непосредственно в изоляции при помощи стандартных клеточных механизмов (например, оксипролин и селенометионин).
Нестандартные аминокислоты, находящиеся в белках, образуются путем пост-трансляционной модификации, то есть модификацией после трансляции в процессе синтеза белка. Эти модификации часто необходимы для функционирования или регуляции белка; например, карбоксилирование глутамата позволяет улучшить связывание ионов кальция, а гидроксилирование пролина важно для поддержания соединительной ткани. Другой пример – формирование гипузина в фактор инициации трансляции EIF5A посредством модификации остатка лизина. Такие модификации могут также определять локализацию белка, например, добавление длинных гидрофобных групп может вызвать связывание белка с фосфолипидной мембраной.
Некоторые нестандартные аминокислоты не встречаются в белках. Это лантионин, 2-аминоизомасляная кислота, дегидроаланин и гамма-аминомасляная кислота. Нестандартные аминокислоты часто встречаются в качестве промежуточных метаболических путей для стандартных аминокислот - например, орнитин и цитруллин встречаются в орнитиновом цикле как часть катаболизма кислоты.
Редкое исключение доминированию альфа-аминокислоты в биологии - бета-аминокислота Бета-аланин (3-аминопропановая кислота), которая используется для синтеза пантотеновой кислоты (витамина B5), компонента коэнзима А у растений и микроорганизмов. Ее, в частности, продуцируют пропионовокислые бактериии.
ФУНКЦИИ АМИНОКИСЛОТ
БЕЛКОВЫЕ И НЕ БЕЛКОВЫЕ ФУНКЦИИ
Многие протеиногенные и непротеиногенные аминокислоты также играют важную, не связанную с образованием белка, роль в организме. Например, в головном мозге человека глутамат (стандартная глутаминовая кислота) и гамма-аминомасляная кислота (ГАМК, нестандартная гамма-аминокислота), являются основными возбуждающими и тормозящими нейромедиаторами. Гидроксипролин (основной компонент соединительной ткани коллагена) синтезируют из пролина; стандартная аминокислота глицин используется для синтеза порфиринов, используемых в эритроцитах. Нестандартный карнитин используется для транспорта липидов.
Из-за своей биологической значимости аминокислоты играют важную роль в питании и обычно используются в пищевых добавках, удобрениях и пищевых технологиях. В промышленности аминокислоты используются при производстве лекарств, биоразлагаемого пластика и хиральных катализаторов.
1. АМИНОКИСЛОТЫ, БЕЛКИ И ПИТАНИЕ
О биологической роли и последствиях дефицита аминокислот в организме человека см. информацию в таблицах незаменимых и заменимых аминокислот.
При введении в организм человека с пищей, 20 стандартных аминокислот либо используются для синтеза белков и других биомолекул, либо окисляются в мочевину и углекислый газ в качестве источника энергии. Окисление начинается с удаления аминогруппы через трансаминазу, а затем аминогруппа включается в цикл мочевины. Другой продукт трансамидирования – кетокислота, которая входит в цикл лимонной кислоты. Глюкогенные аминокислоты также могут быть преобразованы в глюкозу посредством глюконеогенеза.
Из 20 стандартных аминокислот, 8 (валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин) называют незаменимыми потому, что человеческий организм не может синтезировать их самостоятельно из других соединений в необходимых для нормального роста количествах, их можно получить только с пищей. Однако по современным представлениям Гистидин и Аргинин также являются незаменимыми аминокислотами для детей. Другие могут быть условно незаменимы для людей определенного возраста или людей, имеющих какие-либо заболевания.
Кроме того, Цистеин, Таурин, L-Тирозин считаются полузаменимыми аминокислотами у детей (хотя таурин технически не является аминокислотой), потому что метаболические пути, которые синтезируют эти аминокислоты, у детей еще не полностью развиты. Необходимые количества аминокислот также зависят от возраста и здоровья человека, поэтому довольно сложно давать здесь общие диетические рекомендации.
БЕЛКИ
Белки́(протеины, полипептиды) —высокомолекулярныеорганические вещества, состоящие из альфа-аминокислот, соединённых в цепочкупептидной связью. В живых организмах аминокислотный состав белков определяетсягенетическим кодом, при синтезе в большинстве случаев используются 20 стандартных аминокислот.
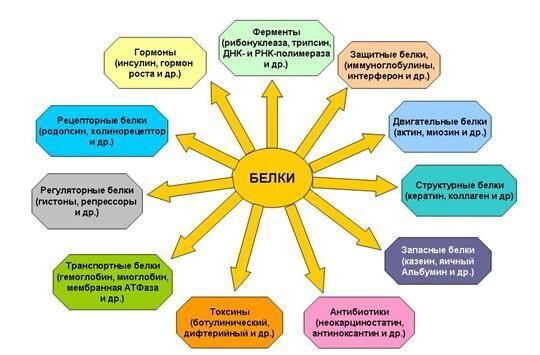
Рис. 9. Белки не только пища... Типы белковых соединений.
Каждый живой организм состоит из белков. Различные формы белков принимают участие во всех процессах, происходящих в живых организмах. В теле человека из белков формируются мышцы, связки, сухожилия, все органы и железы, волосы, ногти; белки входят в состав жидкостей и костей. Ферменты и гормоны, катализирующие и регулирующие все процессы в организме, также являются белками. Дефицит белков в организме опасен для здоровья. Каждый белок уникален и существует для специальных целей.
ПИТАНИЕ И БЕЛКИ

Белки — важная часть питания животных и человека (основные источники: мясо, птица, рыба, молоко, орехи, бобовые, зерновые; в меньшей степени: овощи, фрукты, ягоды и грибы), поскольку в их организмах не могут синтезироваться все необходимые аминокислоты и часть должна поступать с белковой пищей. В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются для биосинтеза собственных белков организма или подвергаются дальнейшему распаду для получения энергии.
 | Белки в организме не являются взаимозаменяемыми. Они синтезируются из аминокислот, которые, в частности, образуются в результате расщепления белков, находящихся в пищевых продуктах. Таким образом, именно аминокислоты, а не сами белки являются наиболее ценными элементами питания. |
Стоит подчеркнть, что современная наука о питании утверждает, что белок должен удовлетворять потребности организма в аминокислотах не только по количеству. Данные вещества должны поступать в организм человека в определенных соотношениях между собой.
Процесс синтеза белков идет в организме постоянно. Если хоть одна незаменимая аминокислота отсутствует, образование белков приостанавливается. Это может привести к самым различным серьезным нарушениям здоровья - от расстройств пищеварения до депрессии и замедления роста у детей. Разумеется, данное рассмотрение вопроса весьма упрощенное, т.к. функции белков в клетках живых организмов более разнообразны, чем функции других биополимеров — полисахаридов и ДНК.
Также, кроме белков, из аминокислот образуется большое количество веществ небелковой природы (см. ниже), выполняющих специальные функции. К ним, напроимер, относится холин (витаминоподобное вещество, входящее в состав фосфолипидов и являющееся предшественником нейромедиатора ацетилхолина - Нейромедиаторы - это химические вещества, передающие нервный импульс с одной нервной клетки на другую. Таким образом, некоторые аминокислоты крайне необходимы для нормальной работы головного мозга).
2. НЕБЕЛКОВЫЕ ФУНКЦИИ АМИНОКИСЛОТ
Нейромедиатор аминокислоты
Прим.: Нейромедиаторы (нейротрансмиттеры, посредники) — биологически активные химические вещества, посредством которых осуществляется передача электрохимического импульса от нервной клетки через синаптическое пространство между нейронами, а также, например, от нейронов к мышечной ткани или железистым клеткам. Для получения информации от собственных тканей и органов организм человека синтезирует особые химические вещества – нейромедиаторы. Все внутренние ткани и органы тела человека, «подчиненные» вегетативной нервной системе (ВНС), снабжены нервами (иннервированы), т. е. функциями организма управляют нервные клетки. Они как датчики собирают информацию о состоянии организма и передают ее в соответствующие центры, а от них корректирующие воздействия идут к периферии. Любое нарушение вегетативной регуляции приводит к сбоям в работе внутренних органов. Передача информации, или управление, осуществляется с помощью специальных химических веществ-посредников, которые называются медиаторами (от лат. mediator – посредник) или нейромедиаторами. По своей химической природе медиаторы относятся к различным группам: биогенным аминам, аминокислотам, нейропептидам и т. д. В настоящее время изучено более 50 соединений, относящихся к медиаторам.
В организме человека многие аминокислоты используются для синтеза других молекул, например:
-
Триптофан является предшественником нейромедиатора серотонина.
-
L-Тирозин и его предшественник фенилаланин являются предшественниками нейромедиаторов дофамина катехоламинов, адреналина и норадреналина.
-
Глицин является предшественником порфиринов, таких как гем.
-
Аргинин является предшественником оксида азота.
-
Орнитин и S-аденозилметионин являются предшественниками полиаминов.
-
Аспартат, Глицин и глутамин являются предшественниками нуклеотидов.
Тем не менее, все еще известны не все функции других многочисленных нестандартных аминокислот. Некоторые нестандартные аминокислоты используются растениями для защиты от травоядных животных. Например, канаванин является аналогом аргинина, который содержится во многих бобовых, и в особо крупных количествах в Canavalia gladiata (канавалия мечевидная). Эта аминокислота защищает растения от хищников, например насекомых, и при употреблении некоторых необработанных бобовых может вызывать заболевания у людей.
КЛАССИФИКАЦИЯ ПРОТЕИНОГЕННЫХ АМИНОКИСЛОТ
Рассмотрим классификацию на примере 20 протеиногенных α-аминокислот, необходимых для синтеза белка
Среди многообразия аминокислот только 20 участвует во внутриклеточном синтезе белков (протеиногенные аминокислоты). Также в организме человека обнаружено еще около 40 непротеиногенных аминокислот. Все протеиногенные аминокислоты являются α-аминокислотами. На их примере можно показать дополнительные способы классификации. Названия аминокислот обычно сокращаются до 3-х буквенного обозначения (см. рис. полипептидной цепи вверху страницы). Профессионалы в молекулярной биологии также используют однобуквенные символы для каждой аминокислоты.
1. ПО СТРОЕНИЮ БОКОВОГО РАДИКАЛА ВЫДЕЛЯЮТ:
-
алифатические (аланин, валин, лейцин, изолейцин, пролин, глицин) — соединения, не содержащие ароматических связей. -
ароматические (фенилаланин, тирозин, триптофан)
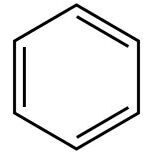 | Ароматические соединения (арены) — циклические органические соединения, которые имеют в своём составе ароматическую систему. Основными отличительными свойствами являются повышенная устойчивость ароматической системы и, несмотря на ненасыщенность, склонность к реакциям замещения, а не присоединения. Различают бензоидные (арены и структурные производные аренов, содержат бензольные ядра) и небензоидные (все остальные) ароматические соединения. Ароматичность — особое свойство некоторых химических соединений, благодаря которому сопряженное кольцо ненасыщенных связей проявляет аномально высокую стабильность; |
| Бензол — одно из наиболее распространённых ароматических соединений |