Файл: Решение Дано m(koh)140 г n экв. (Кон) n экв. (NaОН) m(NaOH) Решение.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 04.02.2024
Просмотров: 40
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
КОНТРОЛЬНЫЕ ВОПРОСЫ
Вариант 2
-
В какой массе NaOH содержится то же количество эквивалентов, что и в 140 г КОН.
Ответ: 100 г.
Решение:
Дано:
m(KOH)=140 г
nЭКВ.(КОН)= nЭКВ.(NaОН)
m(NaOH) - ?
Решение:
Находим молярные массы эквивалентов гидроксида калия и гидроксида натрия:
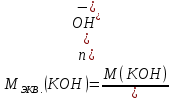
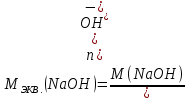
Находим количество вещества эквивалентов гидроксида калия:
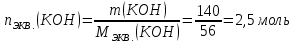
Так как nЭКВ.(КОН)= nЭКВ.(NaОН), nЭКВ.(NaОН)=2,5 моль.
Находим массу гидроксида натрия, в котором содержится 2,5 моль его эквивалентов:
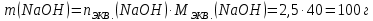
Ответ: m(NaOH)= 100 г.
-
Напишите электронные формулы атомов элементов с порядковыми номерами 16 и 26. Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
Решение:
Электронное строение атома серы:
16S 1s2 2s2 2p6 3s2 3p4
Электронно-графическая формула атома серы:
| n=3 | ↑↓ | ↑↓ | ↑ | ↑ | | | | | | |||
| n=2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | d | |||||||
| n=1 | ↑↓ | p | | | | | | |||||
| | s | | | | | | | | | |||
Так как у атома серы последним заполняется 3р-энергетический подуровень, то сера принадлежит к р-электронному семейству.
Электронное строение атома железа:
26Fe 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Электронно-графическая формула атома железа:
| n=4 | ↑↓ | | | | | | | | | | | | | | | |
| n=3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ | ↑ | ↑ | f | ||||||
| n=2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | d | | ||||||||||
| n=1 | ↑↓ | p | | | | | | | | | | | | | ||
| | s | | | | | | | | | | | | | | | |
Так как у атома железа последним заполняется 3d-энергетический подуровень, то сера принадлежит к d-электронному семейству.
-
Исходя из положения германия, молибдена и рения в периодической системе, составьте формулы водородного соединения германия, оксида молибдена и рениевой кислоты, отвечающие их высшей степени окисления. Изобразите формулы этих соединений графически.
Решение:
Германий находится в четвёртом периоде, четвёртой группе, главной подгруппе. Следовательно, у него 4 валентных электрона. Поэтому для германия характерна высшая степень окисления +4, а низшая степень окисления -4. Германий образует летучее водородное соединение – GeH
4.
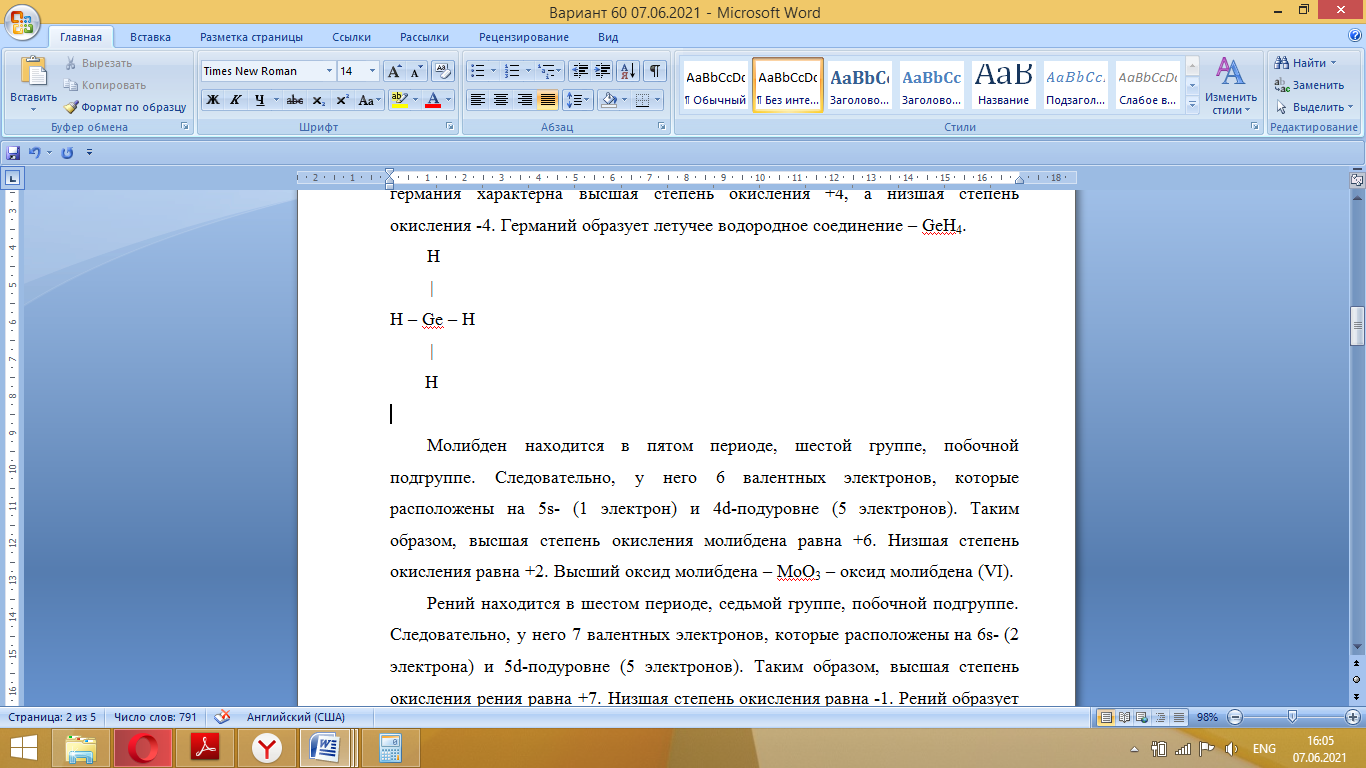
Молибден находится в пятом периоде, шестой группе, побочной подгруппе. Следовательно, у него 6 валентных электронов, которые расположены на 5s- (1 электрон) и 4d-подуровне (5 электронов). Таким образом, высшая степень окисления молибдена равна +6. Низшая степень окисления равна +2. Высший оксид молибдена – MoO3 – оксид молибдена (VI).

Рений находится в шестом периоде, седьмой группе, побочной подгруппе. Следовательно, у него 7 валентных электронов, которые расположены на 6s- (2 электрона) и 5d-подуровне (5 электронов). Таким образом, высшая степень окисления рения равна +7. Низшая степень окисления равна -1. Рений образует рениевую кислоту – HReO4.

-
Газообразный этиловый спирт С2Н5ОН можно получить при взаимодействии этилена C2H4 (r) и водяных паров. Напишите термохимическое уравнение этой реакции, предварительно вычислив ее тепловой эффект.
Ответ: -45,76 кДж.
Решение:
С2Н4 (г) + Н2О (г) = С2Н5ОН (г)
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю находим тепловой эффект вышеуказанной химической реакции, используя следствие из закона Гесса:
∆H0(С2Н5ОН)= -235,1 кДж/моль
∆H0(С2Н4)= 52,28 кДж/моль
∆H0(Н2О)=-241,83 кДж/моль
∆Hх.р. =(1∙∆H0(С2Н5ОН))-(1∙∆H0(С2Н4)+1∙∆H0(Н2О))=(1∙(-235,1))-(1∙(52,28)+1∙(-241,83))=-45,76 кДж
Термохимическое уравнение реакции:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими.
С2Н4 (г) + Н2О (г) = С2Н5ОН (г); ∆Hх.р. =-45,76 кДж
Ответ: ∆Hх.р. =-45,76 кДж.
-
П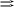 ри какой температуре наступит равновесие системы
ри какой температуре наступит равновесие системы
4 НС1(г) + О2(г) 2 Н2О(г) + 2 Сl2(г); H = -114,42 кДж?
Хлор или кислород в этой системе является более сильным окислителем и при какой температуре?
Ответ: 891 К.
Решение:
Находим изменение энтропии системы в ходе реакции:
ΔS0(HCl(г))= 186,8 Дж/моль∙К
ΔS0(O2(г))=205 Дж/моль∙К
ΔS0(Cl2(г))= 222,9 Дж/моль∙К
ΔS0(H2O(г))= 188,7 Дж/моль∙К
ΔS0х.р.=(2∙ΔS0(H2O(г))+2∙ΔS0(Cl2(г))) – (4∙ΔS0(HCl(г))+1∙ΔS0(O2(г)))=
=(2∙188,7+2∙222,9) – (4∙186,8+1∙205)=-129 Дж/К=-0,129 кДж/К
Находим изменение энергии Гиббса реакции:
ΔG0х.р.= ΔH0-T∙ ΔS0=-116,4-298∙(-0,129)≈-78 кДж
ΔG0х.р. < 0, поэтому при стандартных условиях прямая реакция протекает самопроизвольно. Следовательно, более сильным окислителем является кислород.
Находим температуру, при которой наступит химическое равновесие:
Если пренебречь зависимостями
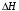 и DS от температуры и считать их постоянными, можно рассчитать энергию Гиббса при нестандартной температуре Т: DG = DН – Т×DS »
и DS от температуры и считать их постоянными, можно рассчитать энергию Гиббса при нестандартной температуре Т: DG = DН – Т×DS »  =
=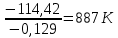
Следовательно, химическое равновесие устанавливается при 887 К.
В интервале температур 0 – 887 К DG < 0, следовательно, прямая реакция протекает самопроизвольно и более сильным окислителем будет кислород; выше 887 К DG > 0, то есть прямая реакция не протекает самопроизвольно, а протекает обратная и более сильным окислителем будет хлор.
-
Напишите выражение для константы равновесия гомогенной системы
N
 2 + 3 H2 2 NН3.
2 + 3 H2 2 NН3.
-
Чему равна молярная концентрация эквивалента 30%-ного раствора NaOH плотностью 1,328 г/см3? К 1 л этого раствора прибавили 5 л воды. Вычислите массовую (процентную) долю полученного раствора.
Ответ: 9,96 н.; 6,3%.
Решение:
Дано:
W1(NaOH)=30 %
ρ1(p-pa)=1,328 г/см3V1(p-pa)=1 л=1000 мл
V(H2O)=5 л=5000 мл или m(H2О))=5000 г, так как ρ(H2О)=1 г/см3
ρ2(p-pa)=1,054 г/см3
СЭКВ.1(NaOH) - ?
W2(NaOH) - ?
Решение:
Находим молярную массу эквивалента гидроксида натрия:
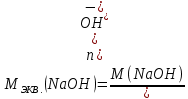
Находим нормальность исходного раствора:
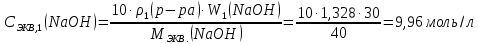
Находим массу исходного раствора:

Находим массу гидроксида натрия в исходном растворе:

Находим объём конечного раствора:
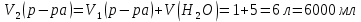
Находим массу конечного раствора:
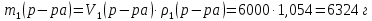
Находим массовую долю гидроксида натрия в конечном растворе:
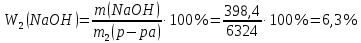
Ответ: СЭКВ.1(NaOH)=9,96 моль/л; W2(NaOH)=6,3 %.
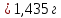
Ответ: СЭКВ.(AgNO3)=0,1 моль/л; m(AgCl)=1,435 г.
-
Вычислите массовую долю (%) водного раствора сахара C12H22O11, зная, что температура кристаллизации раствора - 0,93 °С. Криоскопическая константа воды 1,86.
Ответ: 14,6%.
Решение:
Дано:
tкрист.(р-ра)=-0,93ºС
КК=1,86º
W(C12H22O11) - ?
Решение:
Для решения данной задачи используем второй закон Рауля, согласно которому понижение температуры кристаллизации и повышение температуры кипения раствора прямо пропорционально моляльной концентрации раствора:
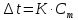
Также можно закон Рауля выразить и по-другому (выражение запишем для нашей задачи, то есть для расчёта изменения температуры кристаллизации раствора):

где
КК – криоскопическая константа растворителя (воды);
m(неэл.) - масса растворенного вещества – неэлектролита (в нашей задаче это глюкоза);
М(неэл.) – молярная маса неэлектролита;
m(р-ля) – масса растворителя (в нашей задаче – это вода).