Файл: Решение Дано m(koh)140 г n экв. (Кон) n экв. (NaОН) m(NaOH) Решение.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 04.02.2024
Просмотров: 41
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Исходя из данной формул можем вывести формулу для нахождения массы глюкозы в растворе:
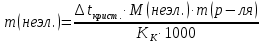
Находим понижение температуры кристаллизации раствора по сравнению с чистым растворителем (водой):
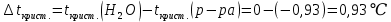
Находим массу сахарозы, которую необходимо растворить в 100 г воды:
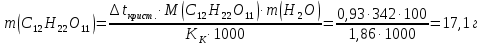
Находим массу раствора сахарозы в воде:
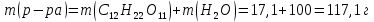
Находим массовую долю глюкозы в растворе:
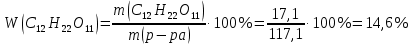
Ответ: W(С12Н22O11)=14,6 %.
-
Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) K2S и НС1;
б) FeSО4 и (NH4)2S; в) Сг(ОН)3 и КОН.
Решение:
а) K2S+2HCl=2KCl+H2S↑
2K++S2-+2H++2Cl-=2K++2Cl-+H2S↑
2H++S2-=H2S↑
б) FeSO4+(NH4)2S=FeS↓+(NH4)2SO4
Fe2++SO42-+2NH4++S2-= FeS↓+2NH4++ SO42-
Fe2++S2-= FeS↓
в) Cr(OH)3+KOH=K[Cr(OH)4]
Cr(OH)3+K++OH-=K++[Cr(OH)4]-
Cr(OH)3+OH-=[Cr(OH)4]-
-
Во сколько раз концентрация ионов водорода в крови (рН = 7,36) меньше, чем в желудочном соке (рН = 1,00)?
Ответ: В 2,3∙10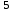 раз.
раз.
Решение:
рН1=7,36
рН2=1,00
[H+]1 - ?
[H+]2 - ?
[H+]1: [H+]2 – ?
Решение:
Находим концентрации ионов Н+ в крови и желудочном соке:
рН=-lg[H+]1
7,36=-lg[H+]1
[H+]1=4,365∙10-8 моль/л
рН=-lg[H+]2
1,00=-lg[H+]2
[H+]2=10-1 моль/л
Находим во сколько раз концентрация ионов Н+ в желудочном соке больше, чем в крови:
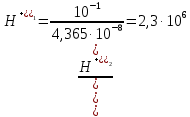
Ответ: в желудочном соке концентрация ионов Н+ больше, чем в крови в 2,3∙106 раз.
-
К раствору FеС13 добавили следующие вещества: а) НС1; б) КОН; в) ZnCl2; г) Na2CO3. В каких случаях гидролиз хлорида железа (III) усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
Решение:
а) FеС13 – соль слабого основания и сильной кислоты, поэтому гидролизуется по катиону, а НС1 диссоциирует в водном растворе:
FeCl3 ↔ Fe3+ + 3Cl-;
Fe3+ + H2O ↔ FeOH2+ + H+;
HCl ↔ H+ + Cl-.
Если растворы этих веществ находятся в одном сосуде, то идёт угнетение гидролиза соли FeCl3, ибо образуется избыток ионов водорода Н+ и равновесие гидролиза сдвигается влево.
б) KOH диссоциирует в водном растворе:
FeCl3 ↔ Fe3+ + 3Cl-;
Fe3+ + H2O ↔ FeOH2+ + H+;
KOH ↔ K+ + OH-.
Если растворы этих веществ находятся в одном сосуде, то идёт гидролиз соли FeCl3 и диссоциации КОН, ибо ионы Н+ и ОН-, связываясь друг с другом, образуют молекулы слабого электролита Н2О (Н+ + ОН- = Н2О). При этом гидролитическое равновесие соли FeCl3 и диссоциация КОН сдвигаются вправо и гидролиз соли и диссоциация основания идут до конца с образованием осадка Fe(OH)3. Таким образом, при смешивании FeCl3 и КОН протекает реакция обмена. Ионно-молекулярное уравнение процесса:
2Fe3+ + 6OH- = 2Fe(OH)3↓
Молекулярное уравнение процесса:
FeCl3 + 6KOH = 2Fe(OH)3↓ + 6KCl
в) Соль FeCl3 и соль ZnCl2 гидролизуются обе по катиону:
Fe3+ + H2O ↔FeOH2+ + H+
Zn2+ + H2O ↔ZnOH+ + H+
Если растворы этих солей находятся в одном сосуде, то идёт взаимное угнетение гидролиза каждой из них, ибо избыточное количество ионов Н+ вызывает смещение гидролитического равновесие влево, в сторону уменьшения концентрации ионов водорода Н+.
г) Соль FeCl3 гидролизуется по катиону, а Na2CO3 – соль сильного основания и слабой кислоты, поэтому гидролизует по аниону:
Fe3+ + H2O ↔ FeOH2+ + H+
CO32- + H2O ↔ HCO3- + ОH-
Если растворы этих солей находятся в одном сосуде, то идёт взаимное усиление гидролиза каждой из них, ибо ионы Н+ и ОН-, связываясь друг с другом, образуют молекулы слабого электролита Н2О (Н+ + ОН- = Н2О). При образовании дополнительного количества воды гидролитическое равновесие обеих солей сдвигается вправо, и гидролиз каждой соли идёт до конца с образованием осадка Fe(OH)3 и слабого электролита H2CO3, то есть протекает совместный гидролиз солей:
2Fe3+ + 3CO32- + 6H2O ↔ 2Fe(OH)3 ↓ + 3H2CO3
2FeCl3 + 3Na2CO3 + 6H2O ↔ 2Fe(OH)3↓ + 3H2CO3 + 6NaCl
или
2FeCl3 + 3Na2CO3 + 3H2O ↔ 2Fe(OH)3↓ + 3CO2 + 6NaCl
-
Реакции выражаются схемами:
Р + НIO3 + Н2О Н3PO4 + НI;
H2S + Cl2 + H2O H2SО4 + НСl.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое— восстановителем; какое вещество окисляется, какое —восстанавливается.
Решение:
Р0 + НI+5O3 + Н2О → Н3P+5O4 + НI-
Р0-5е-→Р+5 6 восстановитель; процесс окисления
30
I+5+6e-→I- 5 окислитель; процесс восстановления
6Р + 5НIO3 + 9Н2О = 6Н3PO4 + 5НI
Р – восстановитель, фосфор отдаёт пять электронов и окисляется.
НIO3 – окислитель, иод присоединяет шесть электронов и восстанавливается.
H2S-2 + Cl20 + H2O → H2S+6О4 + НСl-
S-2-8е-→S+6 1 восстановитель; процесс окисления
8
Cl20+2e-→2Cl- 4 окислитель; процесс восстановления
H2S + 4Cl2 + 4H2O = H2SО4 + 8НСl
H2S – восстановитель, сера отдаёт восемь электронов и окисляется.
Cl2 – окислитель, каждый атом хлора присоединяет один электрон и восстанавливается.
-
Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: а) CuS04; б) MgS04; в) Pb(NO3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
а) CuSО4
Сравним стандартные электродные потенциалы цинка и меди:
E0Zn2+/Zn=-0,762 B
E0Cu2+/Cu=0,337 B
Поскольку медь имеет больший электродный потенциал, то она менее активна, чем цинк и реакция протекает.
Определим как будет изменяться масса цинковой пластинки:
CuSO4 + Zn → ZnSO4 + Cu↓
Zn0 - 2e → Zn+2 | 1 | 1
Cu+2 + 2e → Cu0 | 1 | 1
M(Zn) = 65 г/моль
M(Cu) = 64 г/моль
Из уравнения реакции видно, что когда растворится 1 моль цинка (или 65 г), то на пластину осядет 1 моль меди (или 64 г). В итоге масса пластины уменьшится.
б) MgSO4
Сравним стандартные электродные потенциалы магния и цинка:
E0Mg2+/Mg=-2,38 B
E0Zn2+/Zn=-0,762 B
Поскольку магний имеет меньший электродный потенциал, то он активнее, чем цинк и реакция протекать не будет. Следовательно, масса цинковой пластинки не изменяется.
в) Рb(NО3)2
Сравним стандартные электродные потенциалы свинца и цинка:
E0Pb2+/Pb=-0,126 B
E0Zn2+/Zn=-0,762 B
Поскольку свинец имеет больший электродный потенциал, то он менее активен, чем цинк и реакция протекает.
Определим как будет изменяться масса кадмиевой пластинки:
Pb(NO3)2 + Zn → Zn(NO3)2 + Pb↓
Zn0 - 2e → Zn+2 | 1 | 1
Pb+2 + 2e → Pb0 | 1 | 1
M(Zn) = 65 г/моль
M(Pb) = 207 г/моль
Из уравнения реакции видно, что когда растворится 1 моль цинка (или 65 г), то на пластину осядет 1 моль свинца (или 207 г). В итоге масса пластины увеличится.
-
При электролизе соли некоторого металла в течение 1,5 ч при силе тока 1,8 А на катоде выделилось 1,75 г этого металла. Вычислите эквивалентную массу металла.
Ответ: 17,37 г/моль.
Решение:
Дано:
τ=1,5 ч=5400 с
m(Me)=1,75 г
I=1,8 A
МЭКВ.(Ме) - ?
Решение:
Обобщенный закон Фарадея связывает количество вещества, образовавшегося при электролизе, со временем электролиза и силой тока:
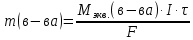 ,
,m - масса образовавшегося вещества , г;
Мэкв.- молярная масса эквивалента вещества, г/ моль;
I - сила тока, А;
t - время электролиза, с;
F - константа Фарадея (96500 Кл/моль).
Отсюда,
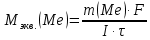
Находим молярную массу эквивалента металла, который выделится на катоде в процессе электролиза:
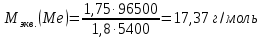
Ответ:
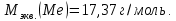
-
Медь не вытесняет водород из разбавленных кислот. Почему? Однако, если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
Решение:
Медь не вытесняет водород из разбавленных кислот потому, что в электрохимическом ряду напряжений металлов медь стоит после водорода , то есть её стандартный электродный потенциал больше, чем у водорода).
Если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода, потому что образуется гальванопара.
E0Cu2+/Cu=0,337 B
E0Zn2+/Zn=-0,762 B
Цинк имеет стандартный электродный потенциал равный -0,762 В. Он меньше, чем стандартный электродный потенциал медного электрода, поэтому цинк выступает в роли анода, а медный электрод в роли катода.
Схема коррозионного гальванического элемента с водородной деполяризацией:
А(-) Zn|H2O,Н+|Cu (+)K
Электродные процессы, протекающие в кислой среде:
А(-): Zn0 – 2ē → Zn2+ 1 процесс окисления
2
K(+): 2Н+ + 2ē → Н2 1 процесс восстановления
Суммарная реакция коррозии:
Zn0 + 2H+→ Zn2+ + Н2↑
Поскольку не указана кислота, в которую погружена гальванопара цинк-медь, то будем считать, что продуктом коррозии в кислой среде является соль цинка (Zn2+ ).
Например, Zn+2HCl→ZnCl2+H2↑
-
Какие соли обусловливают жесткость природной воды? Какую жесткость называют карбонатной, некарбонатной? Как можно устранить карбонатную, некарбонатную жесткость? Напишите уравнения соответствующих реакций. Чему равна жесткость воды, в 100 л которой содержится 14, 632 г гидрокарбоната магния?
Ответ: 2 ммоль/л.
Решение:
Жесткость природной воды обуславливают соли кальция и магния. Карбонатная жесткость обусловлена солями Ca(HCO3)2 и Mg(HCO3)2. Карбонатная (временная) жесткость воды может быть устранена кипячением, так как гидрокарбонаты кальция и магния при кипячении разлагаются.
Ca(HCO3)2
 CaCO3↓+CO2↑+H2O
CaCO3↓+CO2↑+H2OMg (HCO3)2
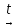 MgCO3↓+CO2↑+H2O
MgCO3↓+CO2↑+H2OНекарбонатная жесткость воды обусловлена присутствием растворимых солей кальция и магния, которые не образуют осадок при кипячении. Чаще всего это хлориды и сульфаты кальция и магния. Некарбонатную (постоянную) жесткость воды устраняют химическими способами. Например, добавление Na