ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 07.09.2024
Просмотров: 51
Скачиваний: 0
СОДЕРЖАНИЕ
Молекулярная физика и термодинамика.
17. История атомистических учений. Наблюдения и опыты, подтверждающие
1. Все тела состоят из частиц – атомов и молекул.
2. Эти частицы находятся в непрерывном хаотическом (тепловом) движении
18. Идеальный газ. Давление газа. Основное уравнение мкт.
19. Тепловое движение. Абсолютная температура как мера средней кинетической
Абсолютная температурная шкала
20. Уравнение Клапейрона-Менделеева. Изопроцессы и их графики.
21. Объяснение агрегатных состояний вещества на основе атомно-молекулярных
22. Насыщенные и ненасыщенные пары. Влажность воздуха. Абсолютная и
23. Внутренняя энергия и работа газа. Первый закон термодинамики
Кпд теплового двигателя
Коэффициентом полезного действия η тепловой машины называется отношение работы A к количеству теплоты Q1, полученному рабочим телом за цикл от нагревателя:
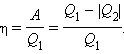
Коэффициент полезного действия η указывает, какая часть тепловой энергии, полученной рабочим телом от нагревателя, превратилась в полезную работу.
Остальная часть (1 – η) была «бесполезно» передана холодильнику.
Коэффициент полезного действия тепловой машины всегда меньше единицы (η < 1).
Первый закон термодинамики не устанавливает направления тепловых процессов. Однако, как показывает опыт, многие тепловые процессы могут протекать только в одном направлении. Такие процессы называются необратимыми. Например, при тепловом контакте двух тел с разными температурами тепловой поток всегда направлен от более теплого тела к более холодному. Никогда не наблюдается самопроизвольный процесс передачи тепла от тела с низкой температурой к телу с более высокой температурой. Следовательно, процесс теплообмена при конечной разности температур является необратимым.
Обратимыми процессами называют процессы перехода системы из одного равновесного состояния в другое, которые можно провести в обратном направлении через ту же последовательность промежуточных равновесных состояний. При этом сама система и окружающие тела возвращаются к исходному состоянию.
Необратимыми являются процессы превращения механической работы во внутреннюю энергию тела из-за наличия трения, процессы диффузии в газах и жидкостях, процессы перемешивания газа при наличии начальной разности давлений и т. д. Все реальные процессы необратимы, но они могут сколь угодно близко приближаться к обратимым процессам. Обратимые процессы являются идеализацией реальных процессов.
Общим свойством всех необратимых процессов является то, что они протекают в термодинамически неравновесной системе и в результате этих процессов замкнутая система приближается к состоянию термодинамического равновесия.
Первый закон термодинамики не может отличить обратимые процессы от необратимых. Он просто требует от термодинамического процесса определенного энергетического баланса и ничего не говорит о том, возможен такой процесс или нет. Направление самопроизвольно протекающих процессов устанавливает второй закон термодинамики. Он может быть сформулирован в виде запрета на определенные виды термодинамических процессов.
Немецкий физик Р. Клаузиус дал другую формулировку второго закона термодинамики:
Невозможен процесс, единственным результатом которого была бы передача энергии путем теплообмена от тела с низкой температурой к телу с более высокой температурой.