ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 07.09.2024
Просмотров: 46
Скачиваний: 0
СОДЕРЖАНИЕ
Молекулярная физика и термодинамика.
17. История атомистических учений. Наблюдения и опыты, подтверждающие
1. Все тела состоят из частиц – атомов и молекул.
2. Эти частицы находятся в непрерывном хаотическом (тепловом) движении
18. Идеальный газ. Давление газа. Основное уравнение мкт.
19. Тепловое движение. Абсолютная температура как мера средней кинетической
Абсолютная температурная шкала
20. Уравнение Клапейрона-Менделеева. Изопроцессы и их графики.
21. Объяснение агрегатных состояний вещества на основе атомно-молекулярных
22. Насыщенные и ненасыщенные пары. Влажность воздуха. Абсолютная и
23. Внутренняя энергия и работа газа. Первый закон термодинамики
При
любых процессах в изолированной
термодинамической системе внутренняя
энергия остается неизменной, ![]()
Например, внутренняя энергия газа состоит из энергии поступательного и вращательного движений молекул и колебательного движения атомов в молекулах, потенциальной энергии молекулярного взаимодействия, энергии электронных оболочек атомов и ионов, энергии движения и взаимодействия нуклонов в ядре.
Внутренняя энергия идеального газа складывается только из энергии движения молекул, так как взаимодействием молекул можно пренебречь.
Изменение внутренней энергии идеального газа
В механике работа определяется как произведение модулей силы и перемещения и косинуса угла между ними.Работа совершаетсяпри действии силы на движущееся тело и равна изменению его кинетической энергии (теорема о кинетической энергии). Работа силы может быть положительной, отрицательной или равна нулю.
В термодинамике движение тела как целого не рассматривается, речь идет о перемещении частей макроскопического тела относительно друг друга. В результате меняется объем тела, а его скорость остается равной нулю.
Работа в термодинамике определяется так же, как и в механике, но равна изменению не кинетической, а внутренней энергии тела.
При совершении работы (сжатии или расширении) изменяется внутренняя энергия газа
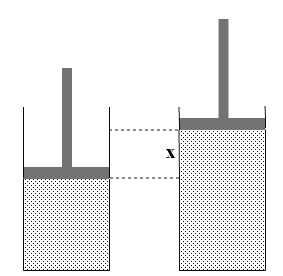
Вычислим работу газа при расширении.
В процессе расширения газ совершает положительную работу А над внешними телами,так как направление силы и перемещения совпадают. При этом газ отдает энергию окружающим телам.
 Если
объем газа изменился
Если
объем газа изменился
на малую величину ΔV,
то газ совершает работу
pSx = pΔV,
где p – давление газа,
pS –сила давления газа на поршень
S – площадь поршня,
x – перемещение поршня.
В результате работа газа при расширениивыражается формулой:
A = pΔV
При расширении работа, совершаемая газом, положительна, при сжатии – отрицательна. В этом случае положительную работу А/ совершают над газом внешние силы
A=-A/.
Первый закон термодинамики
Первый закон термодинамики является законом сохранения энергии, распространенным на тепловые явления.
Внутренняя энергия может изменяться двумя способами: теплопередачей и совершением работы. В общем случае внутренняя энергия изменяется как за счет теплопередачи, так и за счет совершения работы.
Формулировка закона:
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе
ΔU = Q+A
Если система изолирована, то она не обменивается теплотой с окружающими телами (Q=0) и над ней не совершается работа внешних сил (А=0). В этом случае ΔU=0:
Внутренняя энергия изолированной системы сохраняется (остается неизменной).
Учитывая, что А/=-А, первый закон термодинамики можно записать так:
Количество теплоты, переданное системе, расходуется на изменение ее внутренней энергии и совершение системой работы над внешними телами.
Q= ΔU+A/
Первый закон термодинамики
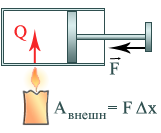
Рис. 2
Первый закон термодинамики(первое начало термодинамики) утверждает, что внутренняя энергия определяется только состоянием системы, причем изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
U=Aвнешн+Q
Если при нагревании газ расширяется и при этом совершает работу A, то первый закон термодинамики можно сформулировать по-другому:
Q=U+A
Количество теплоты, переданное газу, равно сумме изменения его внутренней энергии и работы, совершенной газом.
Работа газа и работа внешних сил вследствие 3-го закона Ньютона равны по модулю и имеют противоположный знак:
Aвнешн= –A
24. Адиабатный процесс. Тепловые двигатели и охрана окружающей среды. Кпд тепловых двигателей. Необратимость тепловых процессов.
В адиабатном процессе Q = 0; поэтому первый закон термодинамики принимает вид
A = ΔU,
Изменение внутренней энергии газа происходит за счет работы внешних сил.
При адиабатном расширении газ совершает работу за счет уменьшения своей внутренней энергии, поэтому температура газа при адиабатном расширении понижается.
Тепловым двигателем называется устройство, способное превращать полученное количество теплоты в механическую работу.
Некоторые виды тепловых двигателей:
паровая машина;
паровая турбина;
двигатель внутреннего сгорания;
реактивный двигатель.
Физические основы работы всех тепловых двигателей одинаковы. Тепловой двигатель состоит из трех основных частей: нагревателя, рабочего тела, холодильник
Э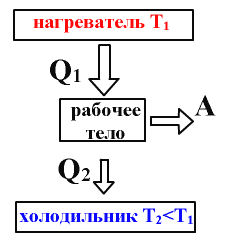 нергетическая
схема тепловой машины
нергетическая
схема тепловой машины
Q1–теплота, полученная рабочим телом
от нагревателя
Q2 – теплота, переданная
рабочим телом холодильнику
А – полезная работа
теплового двигателя
В теоретической модели теплового двигателя рассматриваются три тела: нагреватель,рабочее телоихолодильник.
Нагреватель – тепловой резервуар (большое тело), температура которого постоянна.
В каждом цикле работы двигателя рабочее тело получает некоторое количество теплоты от нагревателя, расширяется и совершает механическую работу. Передача части энергии, полученной от нагревателя, холодильнику необходима для возвращения рабочего тела в исходное состояние.
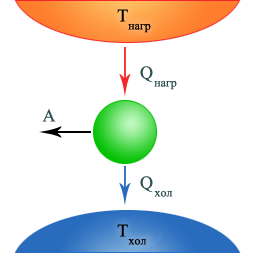
Рис. 1
Так как в модели предполагается, что температура нагревателя и холодильника не меняется в ходе работы теплового двигателя, то при завершении цикла: нагревание-расширение-остывание-сжатие рабочего тела считается, что машина возвращается в исходное состояние.
Для каждого цикла на основании первого закона термодинамики можно записать, что количество теплоты Qнагр, полученное от нагревателя, количество теплоты |Qхол|, отданное холодильнику, и совершенная рабочим телом работаАсвязаны между собой соотношением:
A = Qнагр – |Qхол|.
В реальных технических устройствах, которые называются тепловыми машинами, рабочее тело нагревается за счет тепла, выделяющегося при сгорании топлива. Так, в паровой турбине электростанции нагревателем является топка с горячим углем. В двигателе внутреннего сгорания (ДВС) продукты сгорания можно считать нагревателем, а избыток воздуха – рабочим телом. В качестве холодильника в них используется воздух атмосферы или вода природных источников.