ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 07.07.2024
Просмотров: 44
Скачиваний: 0
Тема17. Загальні шляхи обміну амінокислот.
Актуальність теми
Обмін білків є центральною ланкою всіх біохімічних процесів. Знання і розуміння загальних шляхів перетворень амінокислот, їх метаболітів та визначення активності ферментів, що беруть участь у цих перетвореннях, є критеріями для оцінки обміну білків. У процесі обміну амінокислот утворюються метаболіти, визначення яких у крові та сечі може бути використано з метою застосування фармацевтичних препаратів.
Мета заняття:
вивчити загальні шляхи перетворення амінокислот;
вміти пояснювати шляхи обміну вільних амінокислот;
Конкретні цілі:
Аналізувати шляхи використання вільних амінокислот в організмі людини.
Трактувати процеси трансамінування, дезамінування, декарбоксилування амінокислот.
Визначати активність амінотрансфераз у сироватці крові динітрофенілгідразиновим методом;
Інтерпретувати результати визначення активністі амінотрансфераз у сироватці крові
Теоретичні питання
Основні шляхи використання вільних амінокислот в організмі.
Дезамінування амінокислот:
типи реакцій дезамінування амінокислот і їх кінцеві продукти,
механізм окиснювального дезамінування амінокислот. Гутаматдегідрогеназна реакція, її значення і регуляція.
Оксидази L- і D-амінокислот, їх ферментативна активність, специфічність дії.
Механізм непрямого дезамінування амінокислот.
Трансамінування амінокислот:
субстрати для реакцій трансамінування;
хімічна структура амінотрансфераз;
механізм реакції трансамінування,
біохімічне значення.
Локалізація трансаміназ в органах і тканинах, методи та діагностичне значення їх визначення.
Декарбоксилування амінокислот, фізіологічне значення. Декарбоксилази.
Утворення біогенних амінів (g-аміномасляна кислота, гістамін, серотонін, дофамін), їх значення.
Декарбоксилування амінокислот у процесі гниття білків у кишечнику.
Біогенні аміни як фармпрепарати.
Окиснення біогенних амінів. Амінооксидази (МАО, ДАО) - ферменти знешкодження надлишку біогенних амінів. Фармпрепарати - інгібітори амінооксидаз.
Загальні шляхи метаболізму безазотистого скелета амінокислот в організмі людини. Глюкогенні та кетогенні амінокислоти.
Принцип методу й клінічне значення визначення активності амінотрансфераз (АсАТ, АлАТ) у сироватці крові
Практична робота
Дослід 1. Визначення активності амінотрансфераз (АлАТ й АсАТ)
Принцип методу. у результаті переамінування під дією АсАТ аспарагінова кислота перетворюється у щавлевооцтову (ЩОК), а аланін під дією АлАТ - у піровиноградну кислоту. ЩОК здатна у процесі ферментативної реакції перетворюватися у ПВК. При додаванні кислого 2,4-динітрофенілгідразину (2,4-ДФГ) ферментативний процес припиняється, та утворюється динітрофенілгідразон піровиноградної кислоти, який у лужному середовищі дає коричнево-червоне забарвлення, інтенсивність якого пропорційна кількості утвореної піровиноградної кислоти. Кількість утвореної ПВК дозволяє робити висновок про активність ферменту. Активність амінотрансфераз виражають у мікромолях піровиноградної кислоти, утвореної 1 мл сироватки крові за 1 год інкубації при температурі 370С.
1.1. Визначення активності аланінамінотрансферази
Хід роботи: роботу виконують у відповідності до таблиці.
|
Реактив |
Дослідна проба, мл |
Контрольна проба, мл |
|
Субстратна суміш (аланін і α-кетоглутарат) |
0,5 |
0,5 |
|
У термостат на 5 хв при 370С |
||
|
Сироватка крові |
0,1 |
- |
|
Н2О (дист.) |
- |
0,1 |
|
У термостат на 30 хв при 370С |
||
|
0,1% розчин 2,4-ДФГ |
0,5 |
0,5 |
|
У термостат на 20 хв при 250С |
||
|
0,4н NаОН |
5 |
5 |
|
Примітка. Ретельно перемішують; 10 хв при 250С (для утворення забарвлення). Оптичну густину вимірюють на ФЕКу при λ=500-560 нм (зелений світлофільтр проти контролю в кюветах з товщиною шару 10 мм) проти контрольної проби |
||
Розрахунок активності АлАТ в сироватці крові проводять за калібрувальним графіком, що показує залежність оптичної густини від вмісту піровиноградної кислоти.
Побудова калібрувального графіка:
Приготування калібрувального розчину: 11 мг натрію пірувату розчиняють у невеликій кількості води, переносять у мірну колбу на 100 мл і доводять водою до мітки: 1 мл калібрувального розчину містить 110 мкг натрію пірувату, що відповідає 88 мкг або 1 мкмоль піровиноградної кислоти.
З калібрувального розчину готують низку розведень (див. табл.). Калібрувальні проби проводять так само як дослідні, але замість сироватки додають розведені калібрувальні розчини. Вимірюють проти холостої проби, в яку замість калібрувальних розчинів додають воду. Визначивши оптичні густини будують калібрувальний графік, відкладаючи на вісі абсцис активність ферменту, а на вісі ординат – значення оптичної густини. Калібрувальна крива лінійна до величини оптичної густини 0,3.
Отримання калібрувальних розчинів
|
№ про би |
Калібрувальний розчин натрію пірувату, мл |
Дистильована вода, мл |
Піровиноградна кислота |
Активність АлАТ, нмоль/(с.л) |
||
|
мкг |
мкмоль |
|||||
|
1 |
0,05 |
0,55 |
4,4 |
0,05 |
278 |
|
|
2 |
0,10 |
0,50 |
8,8 |
0,10 |
556 |
|
|
3 |
0,15 |
0,45 |
13,2 |
0,15 |
834 |
|
|
4 |
0,20 |
0,40 |
17,6 |
0,20 |
1112 |
|
Кількість утвореної піровиноградної кислоти (у мкг) знаходять за калібрувальним графіком або за формулою І:
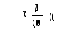
Активність АлАТ вираховують за формулою ІІ:
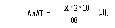
де: Х – кількість піровиноградної кислоти, знайденої за калібрувальним графіком або за формулою І, мкг;
2 – коефіцієнт перерахунку на 1 год інкубації;
10 – коефіцієнт перерахунку на 1 мл сироватки;
88 – маса 1 мкмоль піровиноградної кислоти.
У сироватці крові здорових людей активність АлАТ, визначена за допомогою даного методу, коливається у межах 5-30 од./мл (0,1-0,7 мкм/мл).
Зробити висновок.
1.2 Визначення активності аспартатамінотрансферази
Хід роботи: роботу виконують у відповідності до таблиці.
|
Реактив |
Дослідна проба, мл |
Контрольна проба, мл |
|
Субстратна суміш (аспарагінова кислота + α-кетоглутарова кислота) |
0,5 |
0,5 |
|
У термостат на 5 хв при 370С |
||
|
Сироватка крові |
0,1 |
- |
|
Н2О (дист.) |
- |
0,1 |
|
У термостат на 30 хв при 370С |
||
|
0,1% розчин 2,4-ДФГ |
0,5 |
0,5 |
|
У термостат на 20 хв при 250С |
||
|
0,4н NаОН |
5 |
5 |
|
Примітка. Ретельно перемішують; 10 хв при 250С (для утворення забарвлення). Оптичну густину вимірюють на ФЕКу при λ=500-560 нм (зелений світлофільтр проти контролю в кюветах з товщиною шару 10 мм) проти контрольної проби |
||
Активність ферменту розраховують за формулою
Х = Е · 133 од/мл,
де - Х - активність ферменту;
Е - екстинкція;
133 - коефіцієнт перерахунку.
1 мкг ПВК - 0,015 од. Е; 1 од. Е - 133 мкг ПВК, або за калібрувальним графіком. Активність виражають в умовних одиницях з розрахунку на 1 мл сироватки. 1 од. АсАТ відповідає такій активності ферменту, яка здатна за даних умов утворювати 1 мкг піровиноградної кислоти. При обчисленні активності ферменту необхідно враховувати і розведення сироватки:
Х = а · 10,
де Х - одиниця ферменту;
10 - перерахунок на 1 мл;
а - кількість ПВК, визначена за калібрувальним графіком, мкг.
У сироватці здорових людей активність АсАТ, визначена за допомогою даного методу, коливається від 5 до 40 од./мл (0,1 - 0,5 мкм/мл). Перерахунок активності ферменту в мікромолі ПВК, що утворилася при інкубації 1 мл сироватки впродовж 1год при 370С, проводять за формулою а · 10
 АсАТ
= ,
АсАТ
= ,
88
де а- кількість ПВК, визначена за калібрувальним графіком, мкг;
88 - маса 1 мкмоля ПВК, мкг;
10 - коефіцієнт перерахунку на 1 мл сироватки;
Клініко-діагностичне значення
Лабораторні норми: для АсАТ: 0,1- 0,5 мкмолей ПВК на 1 мл сироватки крові за 1 годину інкубації, для АлАТ: 0,1-0,7 мкмолей ПВК на 1 мл сироватки крові за 1 годину інкубації. У нормі: активність АсАТ сироватки крові становить 0,1 - 0,45 мкмоль/год∙мл; АлАТ - 0,1 - 0,68 мкмоль/год∙мл.
АсАТ і АлАТ є найбільш чутливими індикаторами пошкодження паренхіми печінки (особливо АлАТ). Активність АлАТ, що у 10 і більше разів перевищує верхню межу норми, спостерігають при гострих гепатитах (вірусному і токсичному); підвищення активності ферменту у 5-10 разів характерне для гострих (вірусного, алкогольного, медикаментозного) гепатитів, загострення хронічного активного гепатиту і пухлин печінки. Показники, що вище норми у 1,5-5 разів, спостерігаються при всіх перелічених вище захворюваннях, а також у перший тиждень гострої обтурації загальної жовчної протоки.
Активність АсАТ змінюється подібно до АлАТ, але з меншими потенційними можливостями. Визначення активності амінотрансфераз у сироватці крові має важливе значення для діагностики захворювань серця. При інфаркті міокарда активність АсАТ підвищується у 10-100 разів порівняно з нормою. Активність АсАТ у крові зростає через 4-6 год. після інфаркту міокарда і звичайно повертається до норми на 3-7 день. При стенокардії АсАТ залишається в нормі. Зниження нормальних показників амінотрансфераз у плазмі може бути при недостатності вітаміну В6, а також при нирковій недостатності. У початковому періоді інфаркту міокарда через 24 - 36 годин воно чітко виражене і лише на 3-7-й день активність ферменту нормалізується. Зміни АлАТ при цьому невеликі.