ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 30.07.2024
Просмотров: 48
Скачиваний: 0
Влияние строения и среды на уф-спектры поглощения
На Уф-спектры поглощения многих веществ (хромофоров) оказывает влияние ряд факторов. Проявляться это влияние может изменением интенсивности, формы полос или длины волны, при которой наблюдается поглощения. Наиболее распространенными являются:
-
смещение полос;
-
изменение интенсивности полос.
Полосы поглощения для данного хромофора могут смещаться как в сторону больших, так и меньших длин волн. Смещение в сторону меньших длин волн (больших частот и энергий) называется гипсохромных сдвигом или синим смещением. Смещение в сторону больших длин волн (меньших частот и энергий) называется батохромным сдвигом или красным смещением.
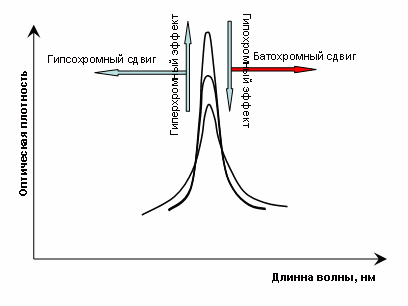
Увеличение интенсивности полосы – называется гиперхромным эффектом, уменьшение – гипохромным эффектом (см. рис. 2.2.1)
|
|
Рис.2.2.1 Типы смещений полосы поглощения в УФ-спектре
Наиболее чувствительны к различным факторам строения и среды являются n → π* и π → π* переходы. Здесь отчетливо проявляются эффекты сопряжения двойных связей в молекулах, полярность заместителей и среды. Рассмотрим последовательно эти три случая.
Сопряжение проявляется батохромным смещением полос поглощения для n → π* и π → π* переходов.
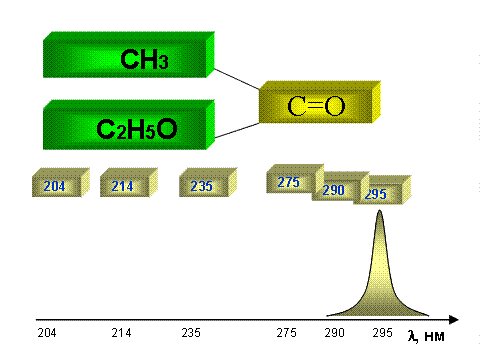
Увеличение полярности заместителя в α-положении такого хромофора как карбонильная группа сопровождается гипсохромным сдвигом n → π* полосы (см рис. 2.2.2).
|
|
Рис.2.2.2 Синее смещение полосы поглощения (n → π* переход) карбонильной группы в следующем ряду соединений (H-, H-); (H-, CH3-); (CH3-, CH3-); (CH3-, Cl-); (CH3-, NH2-); (CH3-, C2H5O-).
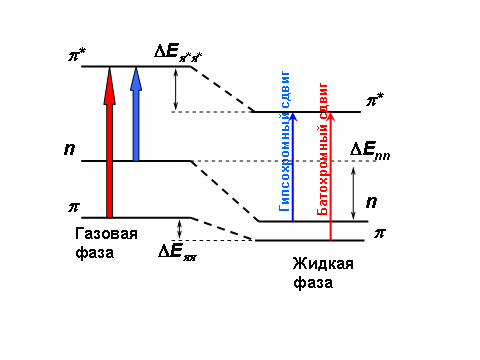
При переходе из газовой фазы в жидкую, или изменении полярности растворителя, энергия основного и возбужденного электронных состояний молекулы изменяется. Это также приводит к гипсо- или батохромным сдвигам полос поглощения для n → π* и π → π* переходов, т.е. оказывают влияние на разность энергий между электронными состояниями(см. рис.2.2.3).
|
|
Рис.2.2.3 Механизм возникновения гипсо- и батохромных сдвигов в электронных спектрах поглощения под влиянием растворителя.
В общем случае влияние растворителя должно проявляться в понижении средней энергии как основного так и возбужденного состояний. И чем больше полярность растворителя, тем сильнее должны быть такие взаимодействия. Однако для того, чтобы произошел сдвиг частоты поглощения, необходимо изменить относительную энергию двух состояний.
Количественный анализ влияния растворителя на спектр поглощения представляет собой достаточно трудную задачу. Когда хромофор находится в основном состоянии, молекулы растворителя располагаются так, чтобы их энергия была минимальной. Процесс возбуждения происходит за время порядка 10-15 с, что значительно меньше характерных времен молекулярных движений. Таким образом, чтобы вычислить длину волны, при которой будет наблюдаться поглощение, нужно знать энергию возбужденного хромофора при конфигурации молекул растворителя, присущей основному состоянию. В таких вычислениях необходимо учитывать два фактора: высокочастотную диэлектрическую проницаемость (определяемую поляризуемостью) и постоянный дипольный момент. Эти факторы различаются тем, что эффекты, связанные с поляризуемостью, проявляются достаточно быстро в ответ на перераспределение электронов при возбуждении, в то время как эффекты, связанные с постоянным дипольным моментом, характеризуются гораздо большими временами.
В эксперименте для π → π* - переходов в полярных растворителях спектр поглощения сдвигается (батохромно) в сторону больших длин волн, а для n → π* - переходов батохромно.
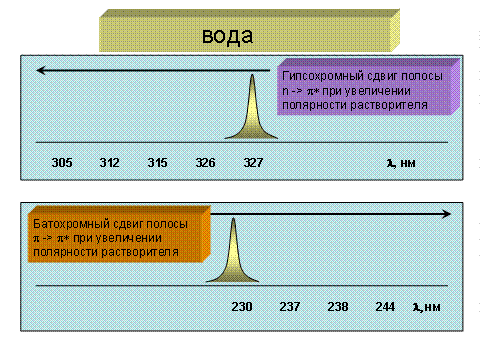
В качестве примера на рис. 2.2.4 приведены данные по влиянию растворителя на n → π* и π → π* переходы в карбонильной группе.
|
|
Рис.2.2.4 Гипсохромный и батохромный сдвиги для n → π* и π → π* переходов (карбонильная группа) в ряду растворителей: гексан, диэтиловый эфир, этанол, метанол, вода.
При n → π* - переходах взаимодействие молекул вещества с растворителем понижает энергию n-орбитали в основном электронном состоянии из-за сольватации или, в частности, при образовании водородной связи. Чем сильнее такое межмолекулярное взаимодействие, тем больше разность ΔЕ энергий состояний, и тем выше частота перехода с n-орбитали на π* разрыхляющую орбиталь.
ЭЛЕКТРОННЫЕ СПЕКТРЫ ПОГЛОЩЕНИЯ ОСНОВНЫХ КЛАССОВ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.
Предельные углеводороды. В этих соединениях содержатся только σ-связи, поэтому в их молекулах возможны только σ → σ* переходы. Соответствующие им полосы поглощения лежат в далеком ультрафиолете:
-
метан – 122 нм
-
этан – 135 нм
-
алканы - < 150 нм.
Для исследования этих соединений методом УФ-спектроскопии требуется специальная техника для работы в области вакуумного ультрафиолета.
Насыщенные углеводороды с гетероатомами. Таковыми являются алканы, содержащие в своем составе атомы О, S, N, галогенов. Они имеют неподеленные пары электронов на несвязывающих n-орбиталях. Для них, наряду с σ → σ* переходами могут наблюдаться и n → σ* переходы (см. табл 2.2.1)
Таблица 2.2.1
Значения длин волн при которых наблюдаются σ → σ* и n → σ* переходы в алканах с гетероатомом
|
Соединение |
λσ → σ*, нм |
λn → σ*, нм |
|
CH3OH |
150 |
177 |
|
CH3Cl |
150 |
173 |
|
CH3NH2 |
170 |
215 |
В области 200 – 800 нм большинство углеводородов и их производных «прозрачны», что позволяет использовать их в качестве растворителей. Для функциональных производных эта область чуть уже: 250 – 800 нм.
Этилены. В непредельных соединениях с одной двойной связью, не содержащих гетероатомы, возможны σ → σ* и π → π* переходы. Последние требуют меньшей энергии (λmax =165 нм.) и являются, поэтому, более интенсивными (εmax > 104). В этилене наблюдается, кроме того, слабое поглощение при λ = 200 нм., которое связывают с одновременным π→ π* переходом двух электронов (запрещенный переход). Алкильные заместители в этилене смещают π→ π* полосу поглощения в красную область, и с ростом числа алкильных заместителей величина батохромного сдвига увеличивается. Причиной красного смещения здесь является гиперконьюгация (сверхсопряжение), т.е. взаимодействие σ-электронов алкильного заместителя с хромофором. Отметим, что группа, которая будучи связана с хромофором, изменяет длину волны и интенсивность поглощения для этого хромофора носит название ауксохрома. Наиболее яко выраженными ауксохромами являются группы с гетероатомом – ОН-, NH2-, галогены и др., т.е. группы, которые содержат неподеленные электронные пары. Ауксохромы проявляются батохромным сдвигом полосы поглощения хромофором, с которым они непосредственно связаны.
Соединения с сопряженными двойными связями. Сопряжение проявляется в УФ-спектрах батохромным сдвигом для полосы π → π* перехода. Объяснение этому эффекту находят в π - π сопряжении, т.е. перекрывании π орбиталей. В результате такого сопряжения образуются две новые связующие и две разрыхляющие МО, что уменьшает разность энергий между ними, т.е. существенно облегчает электронные переходы типа n → π* и π → π* (см. рис. 2.2.5).
|
|
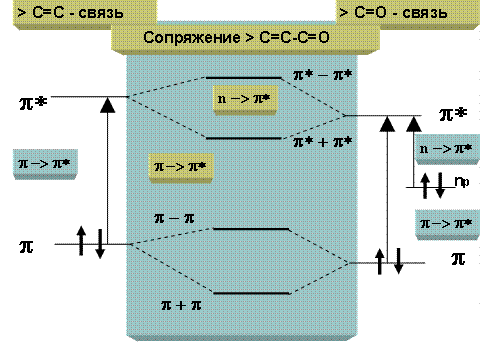 Рис.2.2.5
Образование гибридных (связывающих и
разрыхляющих) π + π π - π орбиталей при π
- π - сопряжении
Рис.2.2.5
Образование гибридных (связывающих и
разрыхляющих) π + π π - π орбиталей при π
- π - сопряжении
Полоса π → π* перехода для изолированной двойной связи (этилене, H2C =CH2 например) имеет максимум при λ = 165 нм, а за счет π - π сопряжения (в бутадиене H2C=HC- CH=CH2) - λ = 217 нм. Если цепь сопряжения в молекуле разорвать (разъединить, например –С=С- связи метиленовой группой -СН2-), то батохромный сдвиг исчезает и наблюдается поглощение характерное для изолированного π → π* перехода в этилене. Имеются эмпирические уравнения и правила,( эмпирических правил Вудворда-
Физера, представляющих собой аддитивную схему, в которой каждомуструктурному фрагменту приписан соответствующий инкремент (λi) которые позволяют рассчитывать длину волны максимума поглощения для соединений с сопряженными двойными связями. Рассмотрим пример таких вычислений. Так, за основу берут бутадиеновый остов. Для этой структуры максимум полосы поглощения принимают равным λmax = 217 нм. Далее к этой величине добавляют значения инкрементов для отдельных фрагментов молекулы, т.е. ведут расчет по формуле:
|
|
Численные значения этих инкрементов приведены в табл. 2.2.2 и считается, что их величины не зависят от структуры молекулы, в состав которой они входят.
Таблица 2.2.2