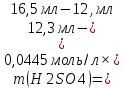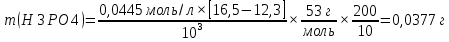ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 06.11.2023
Просмотров: 94
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
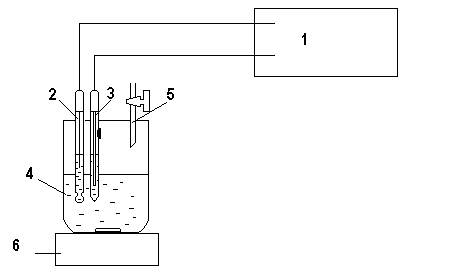
Рисунок 1. Установка для потенциометрического титрования
В таком случае измеренная ЭДС будет зависеть только от потенциала рабочего электрода. На основании изменения величины ЭДС можно судить о концентрации вещества в исследуемом растворе. Для измерения разности потенциалов (ЭДС) собирают электрохимическую ячейку:
-
pH-метр; -
Стеклянный электрод; -
Хлоридсеребряный электрод; -
Электрохимическая ячейка; -
Бюретка с титрантом; -
Магнитная мешалка.
Погрузив два электрода в анализируемый, возникает разность потенциалов, составляющая электродвижущую силу гальванической цепи:
Э
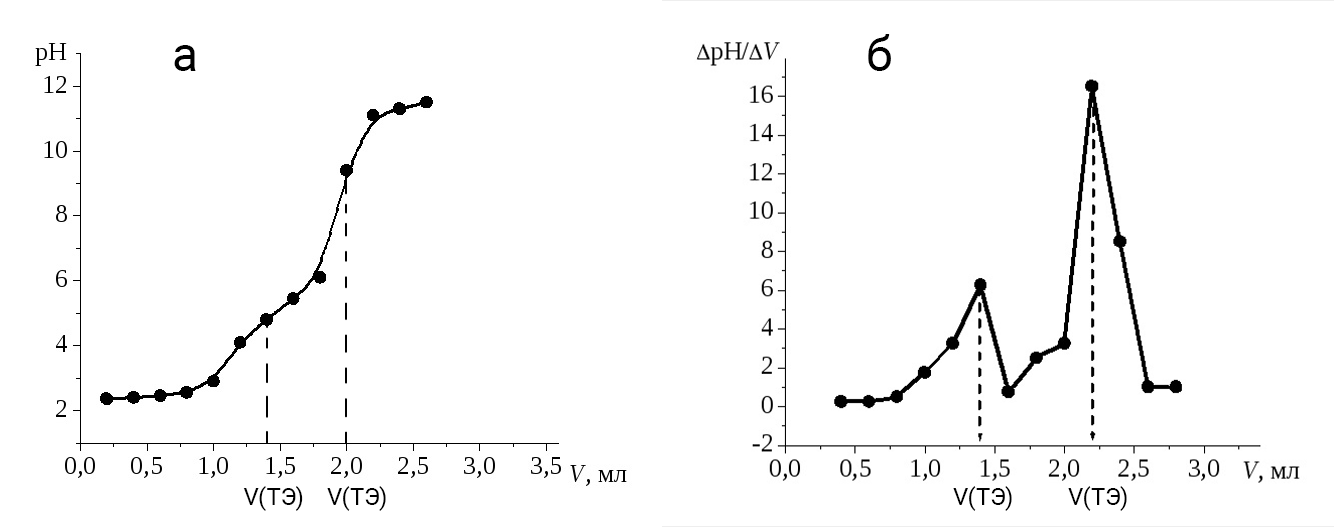
Рисунок 2. а – интегральная кривая; б – дифференциальная кривая
ДС = | Eср. – Eинд. |
Во время потенциометрического титрования каждый раз, добавляя некий объем титранта, фиксируют изменение pH, затем строят интегральную и дифференциальную кривые титрования.
Индикация точки эквивалентности проводится по резкому скачку величины измеряемой ЭДС, которая возникает, из-за изменения равновесного потенциала индикаторного электрода в результате химической реакции. Потенциал рабочего электрода обычно измеряют при нулевом или практически нулевом токе.
Главное преимущество потенциометрического метода по сравнению с другими методами анализа – быстрота и простота проведения измерений. Допускает возможность дифференцированного определения веществ в одном растворе. Время установления равновесного потенциала индикаторных электродов мало, что удобно для автоматизации процессов титрования. Также достоинством является его высокая точность, высокая чувствительность и возможность проводить титрования в более разбавленных растворах, чем это позволяют визуальные индикаторные методы. Необходимо отметить также возможности определения этим методом нескольких веществ в одном растворе без предварительного разделения и титрования в мутных и окрашенных средах.
К недостаткам потенциометрического титрования можно отнести не всегда быстрое установление потенциала после добавления титранта и необходимость во многих случаях делать при титровании большое число отчетов.
Требования к реакциям титрования:
-
высокая скорость прямой реакции, -
строгая стехиометричность и практическая необратимость, -
отсутствие побочных реакций.
Для проведения потенциометрического титрования, прежде всего, подбирают подходящий индикаторный электрод, электрод сравнения и тип электрохимической ячейки.
Требование к индикаторным электродам:
Равновесный потенциал должен устанавливаться быстро
Требования к электродам сравнения:
-
Электрод должен иметь известный и воспроизводимый потенциал -
Электрод сравнения не должен меняться при протекании тока -
Отсутствие влияние на состав раствора -
Простота конструкции
1.1.3 Кислотно-основное титрование
Кислотно-основное титрование — титриметрические методы определения концентрации кислот или оснований, основанные на реакции нейтрализации:
H+ + OH- = H2O
Титрование раствором щелочи называется алкалиметрией, а титрование раствором кислоты — ацидиметрией. При количественном определении кислот (алкалиметрия) — рабочим раствором является раствор щелочи NaOH или КОН, при количественном определении щелочи (ацидиметрия) рабочим раствором является раствор сильной кислоты (обычно НСl или H2SO4).
В качестве титрантов используют сильные кислоты и основания. Титрантами для щелочей выступают сильные кислоты (HCl, H2SO4) – метод ацидиметрии, а титрантами для кислот выступают основания (NaOH, KOH) – алкалиметрия. эти вещества не удовлетворяют требованиям, предъявляемым к первичным стандартам, поскольку они должны быть очень чистыми, достаточно устойчивыми к нагреванию или вакууму и не должны разлагаться. Следовательно, титранты в кислотно-основном титровании являются вторичными стандартными растворами так как не соответствуют строгим критериям, поэтому концентрацию растворов, приготовленных из этих веществ, устанавливают стандартизацией.
Для стандартизации кислот используют первичные стандарты безводную соду Na2CO3 или тетраборат натрия Na2B4O7 * 10H2O.
Для стандартизации щелочей используют первичные стандарты щавелевую кислоту H2C2O4*2H2O, янтарную кислоту H2C4H4O4 или бензойную кислоту C6H5COOH.
Прямое кислотно – основное титрование применяют при определении кислот и оснований различной силы, хорошо растворимых в воде или в подходящем растворителе, если условия титрования позволяют достаточно точно зафиксировать окончание реакции. Если прямое титрование невозможно (титруют очень слабые кислоты, основания или вещества, не обладающие кислотно – основными свойствами, плохо растворимые в воде) применяют обратное или заместительное титрование.
При обратном титровании используют исследуемый и два рабочих раствора, один их, которых является вспомогательным, а второй применяют для титрования. К определённому объёму исследуемого раствора добавляют взятый в избытке объём вспомогательного рабочего раствора.
Не прореагировавший избыток вспомогательного раствора титруется затем вторым рабочим раствором до наступления точки эквивалентности.
Обратным титрованием или косвенными методами находят содержание некоторых солей, например солей аммония или кальция.
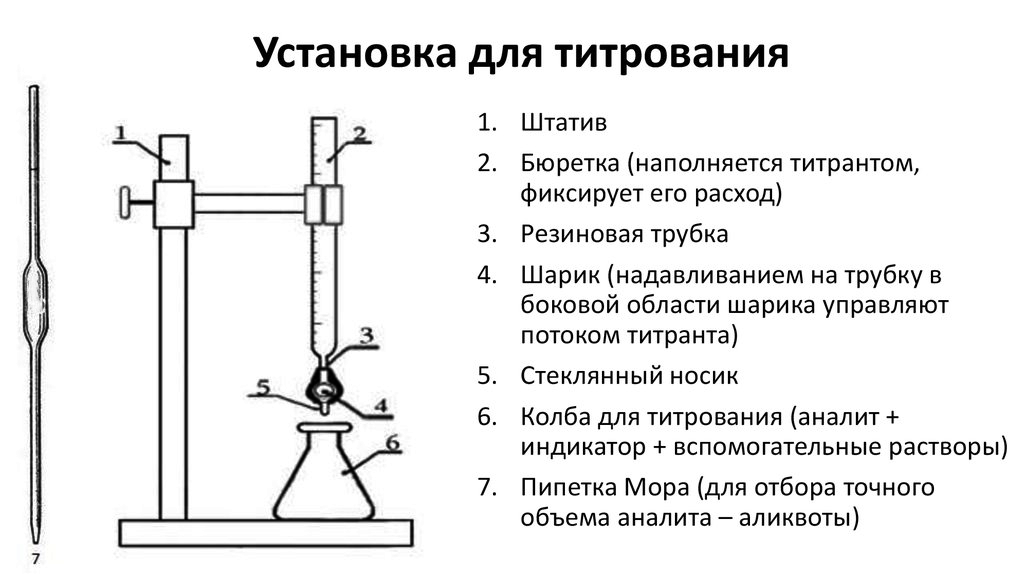
Рисунок 3. Установка для проведения титрования
К
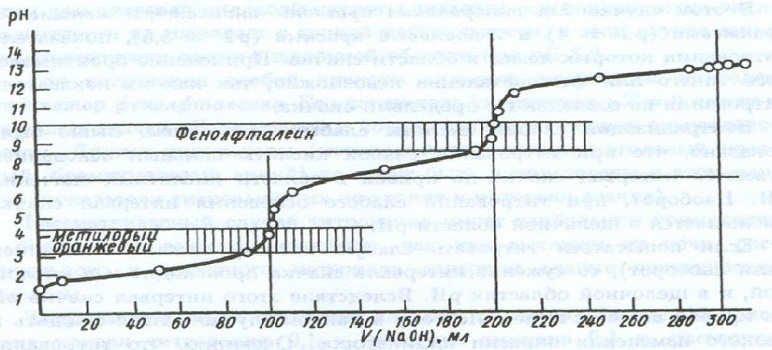
Рисунок 4. Кривая титрования
ривая титрования– это график зависимости рН среды в колбе от объема, добавленного титранта.
Скачок титрования является самой существенной частью кривой титрования, так как на нём всегда лежит точка эквивалентности, с помощью неё осуществляют выбор индикатора. Точка эквивалентности - момент титрования, когда количество прибавляемого титранта строго эквивалентно количеству определяемого вещества. Чтобы понять, достигнута точки эквивалентности или еще нет, обычно используют различные кислотно-основные индикаторы. Для этого перед непосредственным титрованием в колбу с анализируемым раствором добавляют пару капель необходимого индикатора, и в момент достижения точки эквивалентности раствор начинает менять свой цвет. Чем больше скачок титрования, тем точнее будут результаты анализа. На величину скачка титрования влияют, в первую очередь, кислотные и основные свойства исходных веществ, их содержание в растворе, а также температура реакционной среды. Изменение окраски индикатора наступает при определенном значении рН раствора.
Фиксируют конечную точку титрования визуально по изменению цвета окраски индикатора или с помощью pH-метрии.
Требования к кислотно-основным индикаторам:
1. Окраска разных форм индикатора должна быть интенсивной и резко отличаться в кислой и щелочной среде;
2. Изменение окраски должно происходить быстро;
3. Индикатор должен быть чувствителен, должен изменять окраску от одной лишней капли титранта;
4. Изменение окраски индикатора должно быть легко обратимым.
Правила выбора индикатора:
1. pH индикатора должен быть максимально близок к pH в точке эквивалентности;
2. pH индикатора должно входить в скачок титрования.
Экспериментальная часть
2.1 Кислотно-основное титрование
Метод основан на кислотно-основном взаимодействии серной и фосфорной кислот с гидроксидом натрия с образованием продуктов титрования, обладающих менее выраженными кислотными и основными свойствами, чем исходные растворы. Титрование серной и фосфорной кислот раствором гидроксида натрия носит двухступенчатый характер и трехступенчатый соответственно, но для индикации ТЭ нам понадобятся только вторые ступени.
Н3РО4 + NaOH ↔ NaН2РО4 + H2O
NaН2РО4 + NaOH ↔ Na2НРО4 + Н2О
H2SO4 + 2NaOH = Na2SO4 + 2H2O
2.1.1 Расчет стандартизации раствора NaOH по первичному стандарту H2C4H4O4
Используя формулы ниже найдем необходимый объем раствора c приблизительной концентрацией 0,05 моль/л:
CNaOH 1 * V NaOH 1 = C NaOH 2 * VNaOH 2
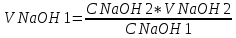
C NaOH 1 и V NaOH 1 – концентрация и объем до разбавления водой
C NaOH 2 и V NaOH 2 – концентрация и объем после разбавления водой
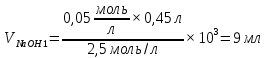
Необходимо взять 6 мл гидроксида натрия концентрацией 2,5 моль/л и разбавить до 300 миллилитров дистиллированной водой для приготовления раствора с концентрацией 0,05 моль/л.
2.1.2 Как приготовить первичный стандарт H2C4H4O4 и стандартизировать NaOH
m (H2C4H4O4) = C1/z (NaOH) * V(H2C4H4O4) * M1/z(H2C4H4O4) *10^3
Для того чтобы определить фактор эквивалентности щавелевой кислоты рассмотрим реакции взаимодействия с гидроксидом натрия
Н2C4H6O4 + 2NaOH → C4H4O4Na2 + 2H2O
Из реакции видно, что янтарная кислота в ходе реакции принимает два протона. Число эквивалентности (z) =2, Фактор эквивалентности (1/z) =1/2
Следовательно, молярная масса будет равна:
M1/z H2C4H4O4 =M/2
M1/z H2C4H4O4 = (1*8+12*4+16*4)/2= 60г/моль
Навеску рассчитывают исходя из того, что концентрация янтарная кислота должна быть 0,05 моль/л. Рассчитанную навеску вещества взвешивают на аналитических весах. Масса полученной навески (Н2C4H6O4) = 0,5902 г. Потом растворяют в небольшом объеме дистиллированной воды. После полного растворения навески раствор количественно переносят в мерную колбу вместимостью 200 мл, доводят водой до риски и перемешивают.
Формула расчета фактической концентрации первичного стандарта:
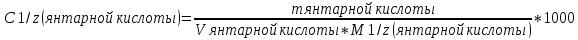
C 1/z (
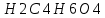 ) =
) =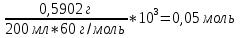 /л
/лНачинаем стандартизовать гидроксид натрия. Чтобы правильно стандартизовать основание, необходимо сначала промыть бюретку два раза титрантом, удаляя всё в колбу для слива, затем заполнить бюретку титрантом при помощи воронки до отметки 0 мл. Воронку перед титрованием снимаем.
Для стандартизации нам необходимо взять пипетку объемом 10 мл и отобрать аликвоту стандартного раствора. Переносим содержимое пипетки в колбу для титрования. Далее добавляем несколько мл воды, и 2–3 капли индикатора фенолфталеина. Раствор приобретает желтоватую окраску. Начинаем титрование, постепенно по капле добавляем титрант в колбу до перехода окраски фиолетового цвета.
Результаты титрований не должны расходиться более чем на 0,2 мл. Результаты титрования сводятся в таблицу. Концентрацию NaOH рассчитывают по формуле:
C 1/z NaOH * V NaOH = C 1/z Н2C4H6O4 * V Н2C4H6O4
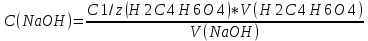
| Номер опыта | Объем Н2C4H6O4 мл | Объем NaOH мл |
| 1 | 10 | 11,1 |
| 2 | 10 | 11,2 |
| 3 | 10 | 11 |
Результаты титрования приведены в таблице.
Находим средний объем NaOH:
Vср NaOH =
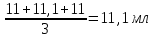
Расчёт концентрации NaOH:
С NaOH =
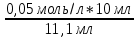 = 0,045моль/л
= 0,045моль/л2.1.3 Определение H2SO4 и H3PO4 в анализируемом растворе.
Сначала смесь кислот титруют гидроксидом натрия в присутствии метил оранжевого. Далее раствор дотитровывают кислотой в присутствии фенолфталеина. Точки эквивалентности определяем по фосфорной кислоте.
Таким образом, пользуясь двумя индикаторами, удается наблюдать две точки эквивалентности: первую, когда H2SO4 будет полностью нейтрализована, а H3PO4 превратится в NaH2PO4.
Первая ТЭ:
pH=1/2(pKа1+ pKа2)
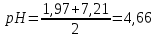
Вторая, когда H2SO4 будет полностью нейтрализована, а H3PO4 превратится в Na2HPO4.
Вторая ТЭ:
pH=1/2 (pKа2+ pKа3)
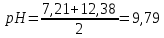
Выполнение работы
Из полученного раствора объема 200 мл в колбу для титрования отбирают аликвоту 20 мл в 3 конические колбы, добавляют несколько капель метилового оранжевого и титруют стандартным раствором гидроксида натрия до окраски оранжевого цвета (V1). Затем подготавливаем еще серию из 3-х растворов и добавляют 3 капли фенолфталеина и титруют стандартным раствором гидроксида натрия до фиолетовой окраски (V2).
| № опыта | Объем пробы, мл | Объем NaOH по метиловому оранжевому, мл | Объем NaOH по фенолфталеиумл | m(H2SO4), г | m(H3PO4), г |
| 1 | 10,0 | 12,3 | 16,5 | | |
| 2 | 10,0 | 12,5 | 16,6 | | |
| 3 | 10,0 | 12,4 | 16,6 | | |
Массу каждого компонента анализируемой смеси рассчитывают по формулам:
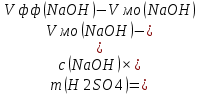
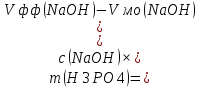
Пример расчета: