Файл: Задача 2 Рутин ( Rutinum) 3 рутозид кверцетина 3рамногликозил3,5,7, 3 1,4 1 пентаоксифлавон.doc
Добавлен: 08.11.2023
Просмотров: 100
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Задача №2
Рутин (Rutinum)
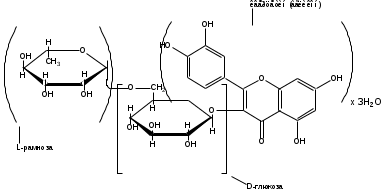
3 – рутозид кверцетина; 3-рамногликозил-3,5,7, 31,41-пентаоксифлавон
М.в. 664,60
Является производным кверцетина (группа флавоноидов)
Описание: зеленовато-желтый мелкокристаллический порошок без запаха и вкуса
Растворимость: практически нерастворим в воде, мало растворим в 95% этаноле, трудно растворим в кипящем этаноле, практически нерастворим в растворах кислот, в эфире, хлороформе, ацетоне, бензоле, растворим в разбавленных растворах едких щелочей.
Подлинность:
-
ИК-спектр в области 4000-700 см-1 должен совпадать со спектром стандарта. -
УФ-спектр в области 240-400 нм имеет максимум поглощения у рутозида – при 258 нм и 362,5 нм. (ГФХ) -
Удельное вращение за счет оптически активных центров. -
ПМР-спектр. Р-р в D4-этаноле должен иметь относительно тетраметилсилана химический сдвиг в виде дублетов 4,49о; 4,90о; 5,87о; 5,91о; 6,79о; 6,84о; 6,96о м.д., группа сигналов в области от 3,0о до 5,0о м.д., относится к растворителю и должен соответствовать прилагаемому к ФС спектру ПМР. -
Хроматограмма, полученная методом ВЭЖХ, на которой должен быть пик, сопоставимый с ГСО этого же вещества. -
Щелочной гидролиз (ГФХ) (образование халкона). ЛП растворяют в р-ре натрия гидроксида. Происходит раскрытие пиранового кольца:
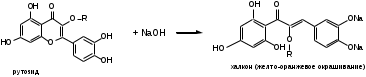
6. Реакция окисления реактивом Фелинга (на глюкозу после кислотного гидролиза). Реакция основана на восстановительных свойствах ЛП. Рутин кипятят с 0,5% р-ром соляной кислоты и фильтруют. К фильтрату прибавляют р-р едкого натра и реактив Фелинга. При кипячении образуется осадок красного цвета. (ГФХ)
-
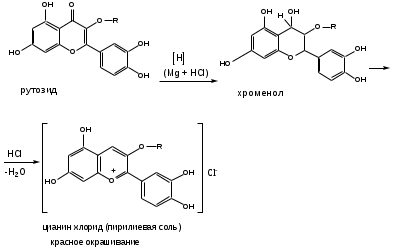
Цианиновая реакция.(ГФХ)
Реакция основана на образовании окрашенных пирилиевых солей при восстановлении водородом флавоноидов. ЛП растворяют в спирте, добавляют несколько капель конц.соляной кислоты и порошка магния или магниевой стружки.
-
Реакция комплексообразования с хлоридом железа(III) (темно-зеленое окрашивание). Реакция основана на наличии фенольного гидроксила. -
Реакция комплексообразования с молибдатом аммония 10%-лимонно-желтое окрашивание. Раствор имеет максимум поглощения в области 380-390 нм. -
С солями тяжелых металов. С солями свинца(оранжевый осадок). -
С р-ром формальдегида в серной кислоте (конц) – красно-оранжевое окрашивание. Реакция основана на наличии в молекуле рутозида фенольного гидроксила. -
С солью диазония (крано-бурое окрашивание). -
Кислотный гидролиз, который происходит в результате кипячения (с обратным холодильником) в присутствии кислоты серной. Образующийся кверцетин, перекристаллизованный из этанола, имеет температуру плавления 308оС. Эту методику используют для гравиметрического определения рутозида.
Чистота:
-
Примеси, нерастворимые в спирте. -
Хлорофилл, пигменты, растворимые в эфире. -
Алкалоиды. -
Кверцетин(не более 5%). Для этого используют УФ-спектрофотометрию и радиальную бумажную хроматографию. Хроматографируют в чашке Петри в 60%-ном растворе уксусной кислоты. После опрыскивания 10%-ным раствором сульфата аммнония хроматограммы сушат и просматривают в УФ-свете при 360 нм. Должно быть только одно пятно кверцетина. -
Потеря в весе при высушивании. -
Сульфатная зола.
Количественное определение:
УФ-спектрофотометрия (ГФХ).
Метод основан на способности ЛП поглощать электромагнитное излучение за счет наличия в структуре сопряженных связей и ароматической структуры.
Растворитель-абсолютный этанол.
Измерения выполняют при 375 и 362,5 нм в кювете толщиной 1 см.
Содержание рутина в % (Х) вычисляют по формуле:
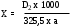
325,5 – удельный показатель поглощения E 1cм1% чистого рутина (безводного) в абсолютном спирте при длине волны 362,5 нм.
а – навеска, г.
Если отношение D1/D2 превышает 0,879, то содержание рутина вычисляют по формуле:
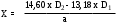 .
.Содержание должно быть не менее 95,0%.
Хранение: в хорошо укупоренной таре, в сухом месте, предохраняя от действия света.
Применение: капилляроукрепляющее средство. Внутрь для профилактики и лечения авитаминоза Р, для лечения нарушения проницаемости сосудов и поражения капилляров.
Источники. Растения: листья руты пахучей, Ruta graveolens), в почках и цветках софоры японской (Sophora japonica) и др. Зеленая масса гречихи, из которой выделяют 1,5 – 6% рутина.
Вопрос: При определении примеси кверцетина в образцах данной серии показания оптической плотности превысили регламентируемую норму. Дать обоснование причинам содержания примеси.
Ответ: Кверцетин получается из рутина путем гидролиза. Возможно превышенное содержание примеси (кверцетина) является результатом неправильного хранения или транспортировки.
Задача №4
Пирацетам (Piracetamum)
Ноотропил (не ГФХ)
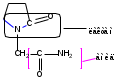
М.в. 142,19
2-(2-оксо-1-пирролидинил)ацетамид
Пирацетам является производным аминокислот.
Описание: белый кристаллический порошок без запаха.
Растворимость: легко растворим в воде, растворим в этаноле, мало растворим в хлороформе, практически нерастворим в эфире.
Подлинность:
-
ИК-спектр после прессования в таблетках с калия бромидом в области 4000-400 см-1, по полному совпадению полос поглощения с прилагаемым к ФС рисунком спектра. -
Кроме того подлинность подтверждают по отсутствию выраженных максимумов поглощения в УФ-спектре 1% водного раствора в интервале 230-350 нм. -
Тпл 151-155оС. -
Щелочной гидролиз. В присутствии натрия гидроксида происходит гидролиз лактама. Подлинность определяют по выделившемуся аммиаку (запах, посинение лакмусовой бумаги).
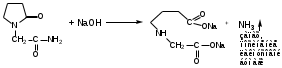
-
Гидроксамовая реакция. Реакция основана на наличии лактамной и амидной группы.
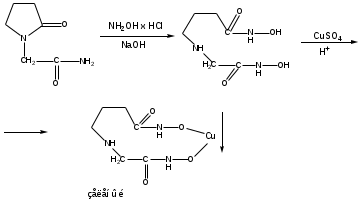
Чистота:
-
Посторонние примеси (не более 0,5%) методом ТСХ на пластинке со слоем силикагеля вместе со свидетелем (растворы в метаноле). Хроматографируют восходящим методом в камере со смесью растворителей хлороформ-метанол-раствор аммиака концентрированный (70:30:3). Проявляют о-толидиновым реактивом, содержащим калия иодид и к-ту уксусную, после обработки пластинки в камере для хлорирования. Хлорирование проводят в камере, где смешивают растворы перманганата калия и кислоты хлороводородной конц.(1:1). -
Прозрачность. -
Цветность. -
рН раствора. -
Сульфатная зола. -
Тяжелые металлы. -
Микробиологическая чистота (метод прямого посева).
Количественное определение:
1. Видоизмененный метод Кьельдаля.
Сущность метода заключается в определении азота.
Метод основан на свойстве амидной группы пирацетама гидролизоваться в щелочной среде с образованием эквивалентного количества аммиака. Определение выполняют с помощью прибора, состоящего из колбы Кьельдаля, парообразователя, холодильника, приемника.
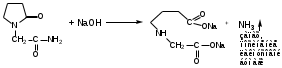
f=1.
Т – 0,1 M NaOH.
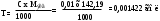
2. Фотоэлектроколориметрия. С помошью цветной реакции, основанной на образовании индофенола. Методика состоит в последовательной обработке пирацетама гипохлоритом натрия и фенолом с последующим фотометрированием окрашенного раствора при 630 нм.
Хранение: список Б, в сухом, защищенном от света месте.
Применение: психотропное (ноотропное) средство при заболеваниях НС, особенно связанных с нарушением обменных процессов мозга и с сосудистыми заболеваниями. Назначают в таблетках, капсулах по 0,4-0,8 г или 20% растворы в ампулах для инъекций.
Кислота глютаминовая (Acidumglutaminicum)
Glutamicacid
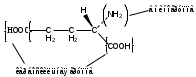
2-аминоглутаровая кислота
Кислота глютаминовая относится к группе аминокислот (белковая аминокислота).
Описание: белый кристаллический порошок с едва ощутимым запахом, кислого вкуса.
Растворимость: мало растворим в воде, растворим в горячей воде, практически нерастворим в 95% спирте и эфире.
Подлинность:
-
ИК-спектр препарата должен полностью совпадать со спектром стандарта. Если совпадение неполное, растворить стандарт и исследуемый образец в минимальном количестве воды, высушить при 60 оС и снова снять спектры препарата и стандарта. -
ГФХ. Удельное вращение от +30о до + 34о (5% раствор в разведенной соляной кислоте). (Препарат имеет ассиметрический атом углерода). ВР-2007. От +30,5о до +32,5о в 1 М растворе HCl. -
ГФХ. Температура плавления не ниже 190оС (с разложением метод 1а). -
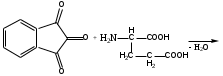
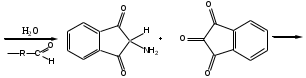
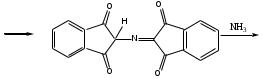
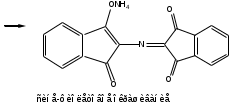
Реакция с нингидрином. Общая реакция на аминокислоты. В основе данной реакции окислительное дезаминирование альфа-аминокислот под действием трикетона – нингидрина. Продукт реакции имеет характерную сине-фиолетовую окраску.
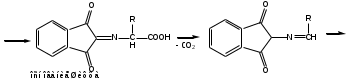
-
Реакция конденсации с резорцином в присутствии серной кислоты концентрированной. Специфическая реакция на кислоту глютаминовую. Реакцию проводят при нагревании до зелено-коричневого окрашивания, пос.ле охлаждения прибавляют воду и раствор аммиака. Появляется сине-фиолетовое окрашивание с зеленой флуоресценцией. Реакция основана на свойстве кислоты глютаминой образовывать при нагревании в присутствии кислоты серной (водоотнимающее средство) устойчивый пятичленный лактам (кислота пирролидонкарбоновая).
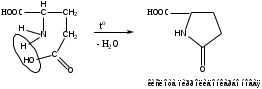
Лактам вступает в реакцию конденсации с резорцином. Продукт имеет красно-фиолетовое окрашивание с зеленой флуоресценцией.
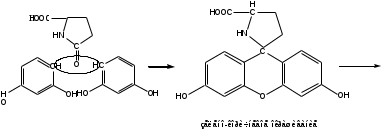
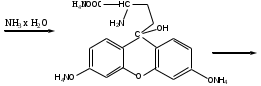
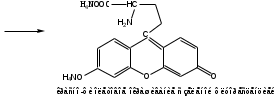
-
ВР-2007. ТСХ со стандартом с последующим проявлением хроматографической пластины раствором нингидрина (реакция см. выше). Положение пятна образца должно соответствовать пятну стандарта. -
ВР – 2007. Реакция доказательства принадлежности ЛВ к группе аминокислот. Препарат растворяют в воде, прибавляют раствор фенолфталеина и несколько капель раствора натрия гидроксида. Появляется розовое окрашивание. Затем прибавляют раствор формальдегида, раствор обесцвечивается. Так как аминокислота находится в цвиттер-ионной форме, при добавлении щелочи (0,1 М) соль не образуется, в растворе присутствует свободная щелочь, окраска в присутствии фенолфталеина розовая.
Чистота.
-
прозрачность и цветность раствора -
рН водного раствора -
Предельное содержание примесей – хлоридов, сульфатов, мышьяка, сульфатная зола и тяжелые металлы.
Количественное определение.
-
ГФХ. Классический метод Кьельдаля. Определение содержания общего азота.
Определение проводят титриметрическим методом после минерализации ЛВ при нагревании с концентрированной серной кислотой в присутствии катализаторов (соли меди, ртути и т.д.) и калия сульфата (для увеличения температуры кипения). Образуется аммония гидросульфат.
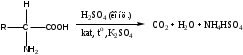
Далее в реакционную среду добавляют избыток натрия гидроксида, происходит разложение гидросульфата аммония.
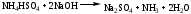
Выделившийся аммиак улавливают раствором кислоты борной, образуется аммония тетрагидроксоборат.
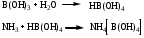
Аммония тетрагидроксоборат титруют раствором кислоты хлороводородной
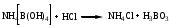
f = 1
Параллельно проводят контрольный опыт.
-
Алкалиметрический метод, вариант нейтрализации. Метод основан на нейтрализации глютаминовой кислоты и образовании ее соли. При правильном подборе индикатора (бромтимоловый синий рН перехода 6,0 – 7,6) глутаминовая кислота титруется как одноосновная. Реакция идет по альфа-карбоксильной группе, которая проявляет более сильные кислотные свойства.