ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 31.03.2024
Просмотров: 63
Скачиваний: 0
Лекция №11.
Уравнение Менделеева - Клапейрона.
Барометрическая формула.
Распределение Больцмана.
Основное уравнение М.К.Т. (уравнение Клаузиуса).
Средне квадротическая скорость молекул газа.
Средняя кинетическая энергия поступательного движения молекул газа.
Закон распределения молекул идеального газа по скоростям и энергиям теплового движения.
1. Уравнение Менделеева-Клапейрона.
Между параметрами
определяющими состояние газа существует
определенная связь, называемая уравнением
состояния.
Его общий вид:
![]() ,
где каждый из параметров является
функцией 2-х других.
,
где каждый из параметров является
функцией 2-х других.
Объединив закон Бойля-Мариотта и Гей-Люссака, Клапейрон вывел уравнение состояния идеального газа
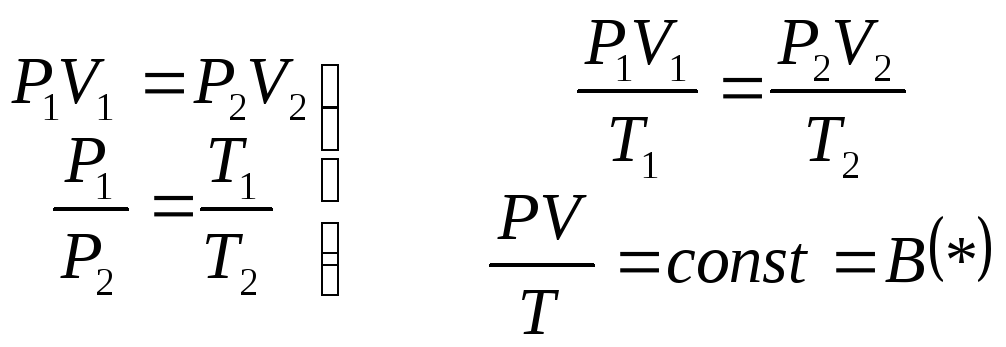 (12.1)
(12.1)
Для данной массы
газа величина
![]() постоянная, различная для различных
газов.
постоянная, различная для различных
газов.
Менделеев объединил
уравнение Клапейрона с законом Авогадро
отнеся уравнение (*) к 1-му молю и использовав
соответственно молярный объемV.
Тогда постоянная
![]() будет одинакова для всех газов и
обозначается
будет одинакова для всех газов и
обозначается
![]() – молекулярная газовая постоянная.
– молекулярная газовая постоянная.![]() (12.2)
(12.2)
![]() и
и
![]() – давление, молярный объем и абсолютная
температура газа.Физический
смысл
– давление, молярный объем и абсолютная
температура газа.Физический
смысл
![]() –универсальная
газовая постоянная,
численно равная работе совершенной 1
молем идеального газа при изобарном
повышении температуры на 1С.
–универсальная
газовая постоянная,
численно равная работе совершенной 1
молем идеального газа при изобарном
повышении температуры на 1С.
![]()
Определяется из уравнения (12.2) при нормальных условиях:
![]()
![]()
![]() и
и
![]()
Для произвольной
массы газа
![]() с молярной массой
с молярной массой![]() и объемом
и объемом![]() уравнение Менделеева-Клапейрона имеет
вид:
уравнение Менделеева-Клапейрона имеет
вид:![]() , (12.3)
, (12.3)
так как
![]() ;
;![]() , (12.4)
, (12.4)
С учетом того что
![]() – концентрация,
– концентрация,![]()
![]() ,
тогда
,
тогда
![]() ;
;![]() –
представляет собой универсальную
газовую постоянную, отнесенную к 1
молекуле.
–
представляет собой универсальную
газовую постоянную, отнесенную к 1
молекуле.
Тогда ![]() (12.5)
(12.5)
Давление идеального
газа при данной
![]() прямо
пропорционально концентрации его
молекул. Из 12.5
прямо
пропорционально концентрации его
молекул. Из 12.5
![]() ,
то есть, при одинаковых
,
то есть, при одинаковых![]() и
и![]() все газы содержат в единице объема
одинаковое число молекул.
все газы содержат в единице объема
одинаковое число молекул.
Число молекул
содержащихся в
![]() газа при нормальных условиях называетсячислом
Лошмидта.
газа при нормальных условиях называетсячислом
Лошмидта. ![]() .
.
Уравнение Менделеева-Клайперона является обобщением экспериментальных газовых законов и включает их в качестве частных случаев.
2. Барометрическая формула.
Из-за хаотичного теплового движения молекулы газа занимают весь предоставленный объем, равномерно заполняя его, в случае, если на молекулы газа не действуют внешние силы. Атмосферный воздух земли не ограничен стенками, но не разлетается – этому препятствует сила земного притяжения.
С другой стороны
при отсутствии теплового движения (![]() )
каждая отдельная молекула газа должна
была бы падать вниз – они скопились бы
у поверхности земли, где их потенциальная
энергия минимальна.
)
каждая отдельная молекула газа должна
была бы падать вниз – они скопились бы
у поверхности земли, где их потенциальная
энергия минимальна.
Благодаря борьбе этих двух противоположных тенденций установлено подвижное равновесие, при котором – концентрация молекул воздуха у поверхности земли максимальна и постепенно уменьшается с высотой.
Так как
![]() ,
следовательно, по мере подъема над
уровнем земли и уменьшением концентрации
будет так же уменьшаться и атмосферное
давление.
,
следовательно, по мере подъема над
уровнем земли и уменьшением концентрации
будет так же уменьшаться и атмосферное
давление.
Зависимость
давления от высоты р(h)
– называется Барометрической
формулой:
![]() (12.6)
(12.6)
Отсчет высоты идет
от уровня моря, где
![]() считается нормальным, поэтому можно
записать
считается нормальным, поэтому можно
записать![]() (12.7)
(12.7)
По этой формуле можно определить атмосферное давление в зависимости от высоты, или, измерив, давление, найти высоту.
![]() –молярная масса;
–молярная масса;
![]() –ускорение
свободного падения;
–ускорение
свободного падения;
![]() –универсальная
газовая постоянная;
–универсальная
газовая постоянная;
![]() –абсолютная
температура;
–абсолютная
температура;
![]() –нормальное
давление.
–нормальное
давление.
Из (12.5) следует, что давление с высотой убывает тем быстрее, чем тяжелее газ.
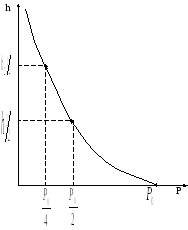
График зависимости:
|
|
Определим высоту, на которой давле |
|
ние газа падает вдвое h1/2)=1/20.Подставим это в (12.7) и получим
|
|
|
то есть при подъеме на высоту 6 км |
|
|
над
уровнем моря,
|
|
|
половины от первоначального значе- |
|
|
ния. При подъеме на 12 км давление |
|
|
упадет
до
|
Измеряя барометром давления в горах можно согласно формуле (12.7) определить высоту места над уровнем моря. На этом принципе основаны устройства авиационных высотомеров - альтиметров.
3. Распределение Больцмана.
Поскольку давление
Р
прямопропорционально концентрации n,
то для зависимости концентрации газовых
молекул от высоты получается аналогичная
формула. 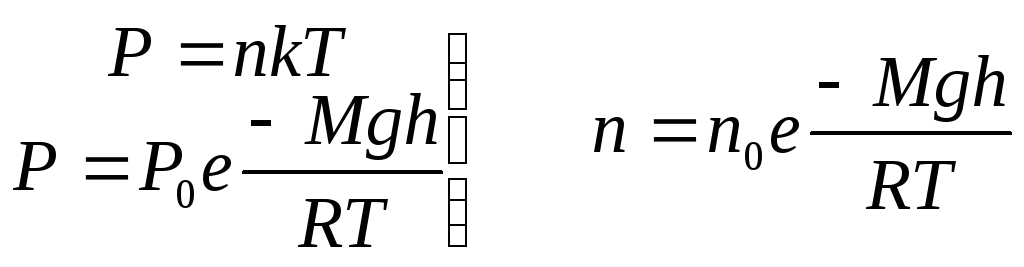 (12.8)
(12.8)
n - концентрация
на высоте h; ![]() – концентрация на высоте
– концентрация на высоте![]()
![]() –молярная масса
молекулы;
–молярная масса
молекулы; ![]() - универ. газовая постоянная
- универ. газовая постоянная
![]() …(12.9)
…(12.9)
где
![]() – представляет собой потенциальную
энергию на высоте h
– представляет собой потенциальную
энергию на высоте h
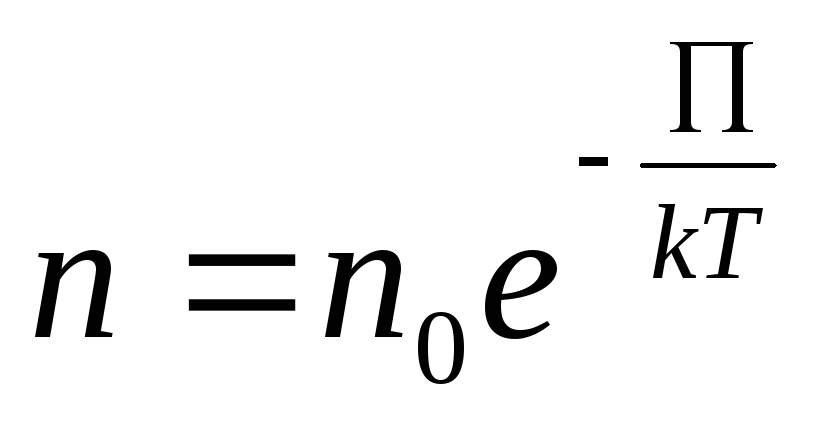 ……….(12.10)
……….(12.10)
Изменение
концентрации молекул с высотой зависит
от соотношения между энергией теплового
движения
![]() и потенциальной энергией молекул на
данной высоте
и потенциальной энергией молекул на
данной высоте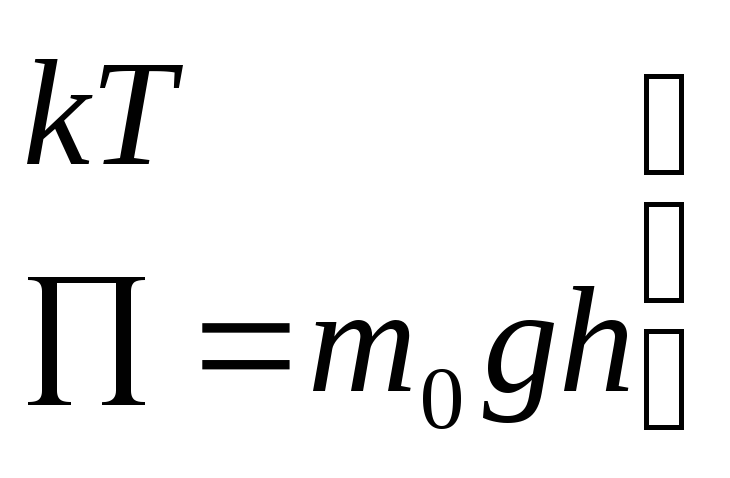
Больцман показал, что соотношение (12.10) остается справедливым в самом общем случае при наличии любых внешних сил, а не только в поле тяжести. Поэтому (12.9) и (12.10) носит название распределение Больцмана.
4. Основное уравнение мкт.
Основным уравнением кинетической теории газов принято называть уравнение устанавливающее связь между давлением газа, его объемом и энергией. Сила давления газа на стенку сосуда складывается из взаимодействий многочисленных молекул всё время ударяющихся об эту стенку и отскакивающих обратно.
Основное уравнение
выводится для идеального газа. Идеальный
газ подчиняется уравнению Менделеева
- Клапейрона
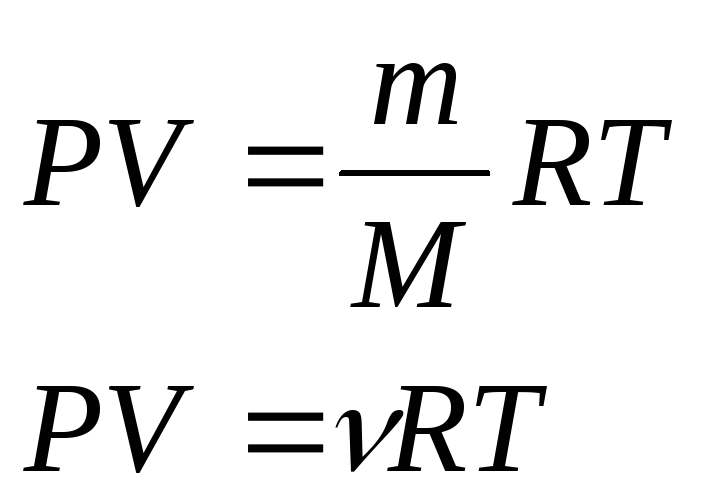 .
Это справедливо, если межмолекулярные
расстояния таковы, что потенциальной
энергией взаимодействия между молекулами
можно пренебречь. Чем меньше эта энергия
взаимодействия между молекулами, тем
лучше удовлетворяет газ уравнению
Менделеева-Клапейрона, тем ближе он по
своим свойствам к идеальному. Полная
энергия идеального газа сводится,
следовательно, к сумме кинетической
энергии всех его молекул.
.
Это справедливо, если межмолекулярные
расстояния таковы, что потенциальной
энергией взаимодействия между молекулами
можно пренебречь. Чем меньше эта энергия
взаимодействия между молекулами, тем
лучше удовлетворяет газ уравнению
Менделеева-Клапейрона, тем ближе он по
своим свойствам к идеальному. Полная
энергия идеального газа сводится,
следовательно, к сумме кинетической
энергии всех его молекул.