ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 07.11.2023
Просмотров: 118
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Анализ жизнеспособности клеток
После кратковременного и среднесрочного воздействия был проведен тест на жизнеспособность тканей с использованием анализа Presto-Blue. Реагент PrestoBlue (Biosource, Камарилло, Калифорния) добавляли к образцам в соотношении 9:1 (объем клеток и культуральной среды: объем реагента Prestoblue). Затем планшеты инкубировали в течение 60 минут при температуре 37°C и 5% CO2. После инкубации образцы объемом 200 мкл трижды помещали в лунки 96-луночного планшета и измеряли интенсивность флуоресценции в каждой лунке при длине волны возбуждения 530 нм и длине волны излучения 590 нм с использованием считывателя флуоресцентных пластин (Infinite 200 PRO TECAN, Швейцария).
Гистологическая и морфологическая оценка
Модельные образцы слизистой оболочки полости рта сначала фиксировали в 10% растворе формалина в течение 24 часов; затем образцы помещали в эмульсионный компаунд с оптимальной температурой резки (OТР) с последующим замораживанием при температуре от -20 до -80°C. Затем образцы были срезаны толщиной 10-30 мкм с помощью криостатного аппарата. После чего срезы были нанесены на гистологические предметные стекла. За этим последовала сушка предметных стекол в течение примерно 30 минут при комнатной температуре. Затем предметные стекла хранили в морозильной камере при температуре -80°C до начала обработки для окрашивания гематоксилином и эозином (H&E).
Слайды были исследованы под световым микроскопом более чем одним экспертом по гистопатологии, чтобы оценить изменения в соединительной ткани и слоях эпителия модели после воздействия тестируемых агентов. Критерии оценки включали непрерывность и толщину эпителия, морфологию клеток, наличие или отсутствие пикнотических ядер, наличие отчетливой поверхности между эпителием и слоем соединительной ткани.
Анализ на заживление ран
Монослойные культуры нормальных фибробластов полости рта и кератиноцитов OKF6/TERT-2 были выращены в 6-луночных планшетах для культивирования тканей и разделены на отрицательный контроль (DMEM), положительный контроль (70% этанол) и тестовые группы с различными концентрациями электронных сигарет (0.1%, 1%, 5%, и 10%) (n=6). Раны были нанесены вертикально в середине поверхности монослойных систем с использованием одноразового клеточного скребка. Испытуемые группы подвергались воздействию питательной среды,
содержащей жидкость для электронных сигарет, непосредственно перед нанесением раны и продолжали ее воздействие ежедневно, а затем за ранами наблюдали до тех пор, пока не наступило полное заживление. Микроскопические изображения получали ежедневно до и после создания раны, чтобы оценить время заживления во всех группах.
Статистический анализ
Для статистического анализа использовался программа SPSS 20. Нормальность данных была проанализирована с помощью теста нормальности (тест Шапиро-Уилка). Средние значения выборок сравнивались с помощью ANOVA с последующим многократным сравнением с использованием тестов Т
ьюки для определения различий между группами. Уровень значимости для всех статистических тестов был установлен на уровне =0.05.
Результаты
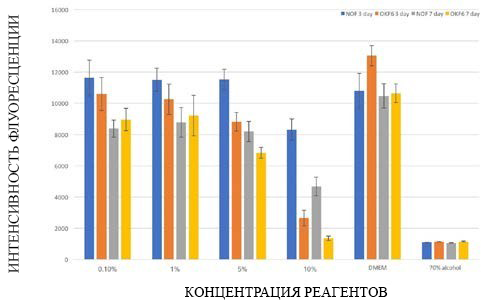
Результаты анализа PrestoBlue для нормальных оральных фибробластов и культур клеток монослоя кератиноцитов OKF6/TERT-2, подвергнутых воздействию различных концентраций электронной жидкости в течение трех и семи дней, показаны на рисунке 1. Кратковременное воздействие 10%-ного раствора электронной жидкости вызывало статистически значимое снижение жизнеспособности NoFS (Р<0,0001) по сравнению с отрицательной контрольной группой. После среднесрочного воздействия все группы с высокой концентрацией электронной жидкости продемонстрировали значительно более низкую жизнеспособность по сравнению с группой с отрицательным контролем.
Монослои кератиноцитов OKF6/TERT-2 показали значительно более низкую жизнеспособность после кратковременного воздействия всех концентраций электронной жидкости, тогда как среднесрочное воздействие привело к значительно более низкой жизнеспособности во всех группах, за исключением группы с концентрацией 1%, по сравнению с отрицательной контрольной группой.
Монослои кератиноцитов TR146 не показали какой-либо статистически значимой разницы в жизнеспособности между группами с различной концентрацией электронной жидкости по сравнению с группой отрицательного контроля после кратковременного воздействия. Однако среднесрочное воздействие 5%-ного и 10%-ного раствора электронной жидкости вызвало статистически значимое увеличение жизнеспособности кератиноцитов TR146 по сравнению с отрицательной контрольной группой (рис. 2).
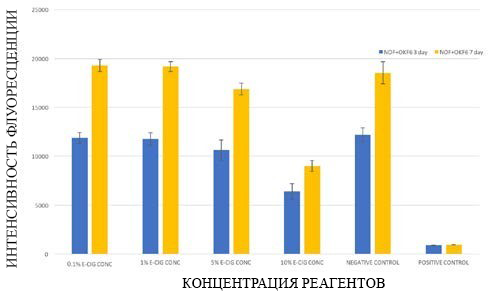
Система совместного культивирования нормальных фибробластов полости рта и кератиноцитов OKF6/TERT-2 показала значительное снижение жизнеспособности клеток в группе с концентрацией электронной жидкости 10% после кратковременного воздействия. Напротив, среднесрочное воздействие привело к значительно более низкой жизнеспособности в группах с концентрацией 5% и 10% (Р<0,0001) по сравнению с отрицательной контрольной группой (рис. 3). Гистологические
Рисунок 1. Жизнеспособность тканей нормальных фибробластов полости рта и монослойных клеточных культур кератиноцитов OKF6, подвергшихся воздействию различных концентраций электронной жидкости, оцененная с помощью анализа PrestoBlue.
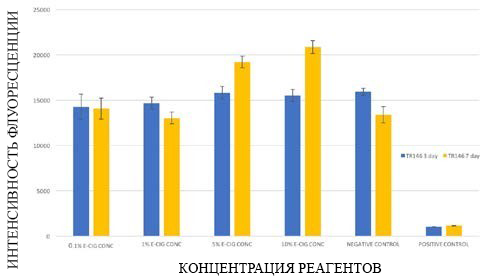
Рисунок 2. Жизнеспособность тканей монослойных клеточных культур кератиноцитов TR146, подвергшихся воздействию различных концентраций электронной жидкости, оцененная с помощью анализа PrestoBlue.
трехмерные модели слизистой оболочки полости рта с использованием кератиноцитов NoFS и TR146 показали увеличение толщины слоя ракового эпителия в группах с высокой концентрацией электронной жидкости по сравнению с отрицательным контролем после кратковременного и среднесрочного воздействия (рисунки 4 и 5).
На рисунке 6 показаны микроскопические изображения заживления ран на разных стадиях для нормальных фибробластов полости рта и кератиноцитов OKF6/TERT-2. В таблице 1 представлены средние значения и стандартные отклонения общего времени заживления ран для контрольной и испытуемой групп. Наблюдалась статистически значимая разница во времени заживления ран как в монослойных системах NOF, так и в системах OKF6/TERT-2, подвергнутых воздействию 1%, 5% и 10% растворов электронной жидкости, по сравнению с таковыми в группе отрицательного контроля (Р<0,05).
Обсуждение
В этом исследовании были использованы три различных типа клеток, включая NoFS, кератиноциты OKF6/TERT2 и раковые кератиноциты TR146. Были выбраны нормальные фибробласты полости рта, поскольку считается, что они играют важную роль в заживлении ран на слизистой оболочке; они также отвечают за синтез внеклеточного матрикса в слое соединительной ткани. Кератиноциты OKF6/TERT-2 обладают высокой воспроизводимостью, позволяют избежать
вариаций от партии к партии; они были отобраны для представления нормальных эпителиальных клеток полости рта. И наоборот, клетки TR146, полученные из плоскоклеточной карциномы, были использованы для оценки воздействия электронной жидкости на раковые клетки п
олости рта.
Рисунок 3. Жизнеспособность тканей нормальных
фибробластов полости рта и 3D-систем ко-культуры
кератиноцитов OKF6, подвергнутых воздействию различных концентраций электронной жидкости, оцененная с помощью анализа PrestoBlue.
Электронная жидкость без добавления ароматизаторов была использована для устранения смешивающего эффекта различных добавок, который наблюдается при использовании различных типов ароматизаторов в электронных сигаретах. Различные исследования показали, что определенные ароматизаторы, такие как ментол, корица, карамель, ириски, жевательная резинка и кофе, оказывают большее цитотоксическое воздействие на клетки по сравнению с некоторыми другими ароматизаторами.39-41
Четыре различные концентрации (0.1%, 1%, 5%, и 10%) раствора электронной жидкости были приготовлены для оценки воздействия различных концентраций электронной жидкости на клетки, охватывающих диапазон от простых курильщиков до заядлых потребителей электронных сигарет. Продолжительность воздействия включала три дня и семь дней для имитации кратковременного и среднесрочного курения.
Электронная жидкость без добавления ароматизаторов была использована для устранения смешивающего эффекта различных добавок, который наблюдается при использовании различных типов ароматизаторов в электронных сигаретах. Различные исследования показали, что определенные ароматизаторы, такие как ментол, корица, карамель, ириски, жевательная резинка и кофе, оказывают большее цитотоксическое воздействие на клетки по сравнению с некоторыми другими ароматизаторами.
39-41
Четыре различные концентрации (0.1%, 1%, 5%, и 10%) раствора электронной жидкости были приготовлены для оценки воздействия различных концентраций электронной жидкости на клетки, охватывающих диапазон от простых курильщиков до заядлых потребителей электронных сигарет. Продолжительность воздействия включала три дня и семь дней для имитации кратковременного и среднесрочного курения.
В этом исследовании жидкость для электронных сигарет оказывала неблагоприятное воздействие на жизнеспособность
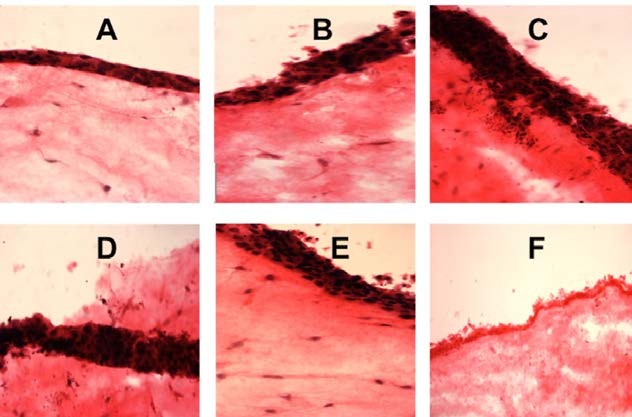

Рисунок 4. Гистологические срезы 3D тканеинженерных моделей слизистой оболочки полости рта после кратковременного воздействия (A) 0,1% эл. жидкости; (B) 1% эл. жидкости; (C) 5% эл. жидкости; (D) 10% эл. жидкости; (E) отрицательный контроль; (F) положительный контроль (окрашивание H & E, оригинальное увеличение ×10
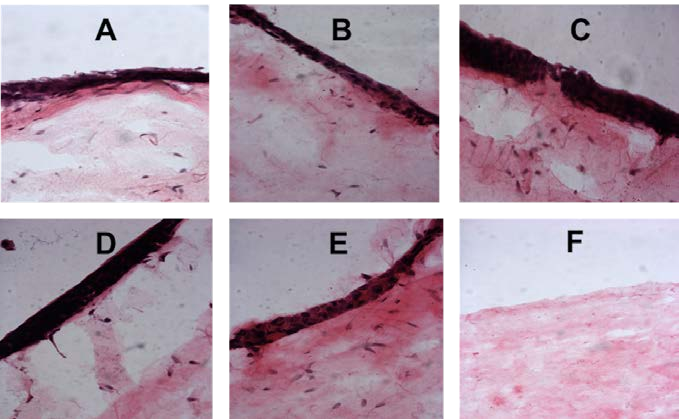
Рисунок 5. Гистологические срезы 3D тканеинженерных моделей слизистой оболочки полости рта после среднесрочного воздействия (A) 0,1% эл. жидкости; (B) 1% эл. жидкости; (C) 5% эл. жидкости; (D) 10% эл. жидкости; (E) отрицательный контроль; (F) положительный контроль (H & E окрашивание, оригинальное увеличение ×10).
нормальных фибробластов полости рта и кератиноцитов OKF6/TERT-2. Эти результаты согласуются с предыдущим исследованием, в котором различные типы жидкостей для электронных сигарет тестировались на фибробластах периодонтальной связки человека и показали снижение жизнеспособности клеток в образцах, подвергшихся воздействию электронных жидкостей.39
И наоборот, в нашем исследовании наблюдалось дозозависимое стимулирующее действие электронной жидкости на рост раковых клеток TR146, демонстрирующее повышенную жизнеспособность и пролиферацию клеток TR146 с увеличением концентрации электронной жидкости. Аналогичным образом, гистологическая оценка трехмерных моделей слизистой оболочки полости рта показала увеличение толщины слоя ракового эпителия, подвергшегося воздействию высоких концентраций электронной жидкости. Это первое исследование, в котором сообщается об использовании полноразмерной тканеинженерной 3D-модели слизистой оболочки полости рта для биологической оценки воздействия электронных сигарет на ткани полости рта, пораженные раком. Эти результаты ранее не публиковались и могут указывать на стимулирующее опухоль действие ингредиентов электронной жидкости, протестированных в данном исследовании.
Предыдущие исследования вызвали некоторые опасения относительно потенциального воздействия никотина на развитие опухолей в легких посредством различных возможных механизмов, таких как миграция клеток, пролиферация и ангиогенез.20-21