ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 02.12.2023
Просмотров: 55
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
Для микроорганизмов, особенно автотрофных бактерий и дрожжей, условия выращивания довольно просты. Их выращивают в жидкой среде, представляющей собой раствор солей и простых органических соединений. Культуру содержат при постоянной температуре и перемешивают, причем из резервуара в нее постоянно поступает стерильная среда. (Рис.1)
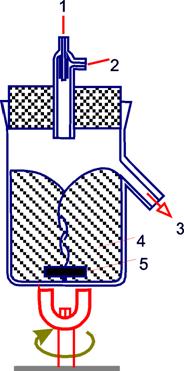
Рис.1.
1 – регулятор
2 – поступление субстрата,
3 – отток (вымывание) смеси субстрата и биомассы,
4 – культура внутри культиватора,
5 – мешалка
При построении моделей в микробиологии в качестве равноправных переменных используют как концентрации микроорганихзмов, так и концентрации различных растворимых органических и неорганических веществ: субстратов, ферментов, продуктов. В микробиологии общепринят эмпирический подход к построению моделей. Из всех факторов, влияющих на рост клетки, выбирают лимитирующий, и опытным путем находят зависимость скорости роста от его концентрации. Особый класс составляют задачи, где в процессе роста происходит смена лимитирования.
В общем виде кинетика концентрации клеток в непрерывной культуре описывается уравнением:
Здесь x – концентрация клеток в культиваторе; µ ‑ функция, описывающая размножение популяции. Она может зависеть от концентрации клеток x, концентрации субстрата (обычно обозначается S), температуры, рН среды и прочих факторов; n - скорость вымывания.
Без учета вымывания клеток рост биомассы описывается уравнением:
При неограниченных ресурсах питательных веществ величина µпостоянна, и уравнение (2) описывает экспоненциальный рост популяции клеток. Если же какие-либо причины начинают лимитировать рост, величина µ будет уменьшаться. Для микробиологических систем обычно величина, лимитирующая рост, это ‑ концентрация субстрата. Наиболее распространенная форма записи, учитывающая насыщение скорости роста культуры по питательному субстрату, предложена Моно:
(3)
Здесь mm -максимальная скорость роста микроорганизмов при данных условиях; KS- константа, численно равная концентрации субстрата, при которой скорость роста культуры равна половине максимальной. График функции величины скорости роста от концентрации субстрата приведен на рис. 2
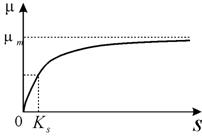
| |
| Рис. 2 График зависимости скорости роста от концентрации субстрата в соответствии с формулой Моно (3) |
Вид уравнения Моно аналогичен формуле Михаэлиса-Ментен из ферментативной кинетики. И это не только формальное сходство. В основе жизнедеятельности любой клетки лежат ферментативные процессы. Скорость роста биомассы в конечном счете определяется скоростью переработки лимитирующего субстрата ферментом узкого места в метаболической сети. Пусть концентрация фермента на единицу биомассы равна E0. Тогда по закону Михаэлиса, скорость переработки субстрата единицей биомассы определяется формулой:
Здесь Km- константа Михаэлиса,k - константа скорости реакции. Вся биомасса концентрации x обладает количеством фермента E0x, Следовательно, суммарная скорость убыли субстрата равна
4. Производство кормовых липидов.
Основной источник незаменимых жирных кислот для сельскохозяйственных животных – различные растительные продукты, входящие в состав кормов. Однако в растительных кормах содержится мало липидов или они имеют неблагоприятный состав жирных кислот, что ухудшает питательную ценность кормов. В целях балансирования кормовых рационов сельскохозяйственных животных по содержанию незаменимых жирных кислот осуществляется поиск новых источников биологически полноценных липидов, которые можно было бы использовать в качестве высококонцентрированных кормовых добавок.
Наиболее перспективными промышленными продуцентами липидов, близкими по составу к растительным жирам и пригодными для использования в кормовых целях, являются дрожжи и микроскопические грибы, которые накапливают внутриклеточные липиды. Однако известны виды, способные выделять липиды в культуральную жидкость. В клетках этих микроорганизмов обычно содержится от 25 до 70% липидов в расчёте на сухую массу, которые на 40-90% представлены триацилглицеринами и на 5-50% - фосфолипидами. В них также содержится много стероидных веществ (до 1-1,5% на сухую массу),
представленных главным образом эргостерином, из которого в организме животных образуется витамин D2.
Много липидов (50-60% от сухой массы) способны накапливать некоторые штаммы дрожжей Phodotorula, Lipomyces.Клетки дрожжей рода Candida синтезируют меньше липидов (20-40%), однако отличаются высокой скоростью роста и способностью хорошо утилизировать разнообразные источники сырья. Микроскопические грибы могут синтезировать до 40-50% высокоценных липидов, сходных по составу жирных кислот с растительными
Из-за образования в клетках микроорганизмов активных комплексов гидролитических ферментов они способны утилизировать в качестве источников углерода различные субстраты – гидролизаты растительных отходов, послеспиртовую барду, молочную сыворотку, мелассу, отходы зерноперерабатывающей промышленности и др[1].
В качестве источника азота в питательную среду добавляют дрожжевой или кукурузный экстракт, соли аммония, мочевину, но при этом строго контролируют соотношение углерода и азота, так как при избытке азота снижается образование липидов в клетках микроорганизмов.
Этапы технологии производства липидов на питательной среде включает:
1.Начальный период интенсивного роста микроорганизмов и сравнительно небольшое накопление липидов;
2.Усиление синтеза липидов в начале стационарной фазы развития микроорганизмов;
3.При выращивании продуцентов кормовых липидов поддерживается температура 20-30°С, так как при более высокой температуре снижается выход липидов, а в липидах уменьшается доля полиненасыщенных жирных кислот;
4.В процессе ферментации требуется поддерживать режим интенсивной аэрации, так как для окисления углеродных субстратов необходим кислород. Он также необходим для синтеза ненасыщенных жирных кислот, поэтому улучшение аэрации стимулирует увеличение выхода незаменимых жирных кислот;
5.По окончании ферментации микробная масса отделяется от остатков субстрата и высушивается по такой же технологии, как кормовые дрожжи. Для улучшения физических свойств к высушенному продукту добавляют отруби или кукурузную муку.
5. Охарактеризовать действие комплексных ферментных аппаратов, применяемых на стадиях осахаривания и брожения при производстве этилового спирта.
Производство спирта основано на конверсии сбраживаемых органических соединений в этанол с помощью культур дрожжей, реже- грибов и бактерий. В России. этанол производится из зернового сырья и картофеля, а в качестве возбудителей брожения используются дрожжи- сахаромицeты.
Для того чтобы увеличить выход спирта, следует решить две задачи: первая- полностью гидролизовать крахмал и некрахмальные полисахариды в сбраживаемые сахара; вторая - обеспечить дрожжи питательными элементами, необходимыми для быстрого размножения и синтеза ферментов.
Осахаривание крахмала осуществляют использованием солода и микробных ферментных препаратов - б -амилазы и глюкоaмилазы. Применение a-aмилазы на стадиях разваривания и осахаривания позволяет снизить вязкость замесов, достичь высокой полноты клейстеризации крахмальных гранул, предотвратить ретpадацию крахмала, препятствующую его осахариванию.
Для разжижения крахмала целесообразно применять препараты термостабильной а-амилазы, которые выделяют из культуры В. licheniforms (импортные-«Термамил», «Така-Терм», «Зимаджунт», отечественный -«Амиололихeтерм»). Различные штаммы бактерии licheniformis продуцируют амилазу с оптимумом действия в интервале от 76 до 95 °С . В средах с высокой концентрацией крахмала, в присутствии микродобавок соли СаCl2, «Термамил» стабилен в течение 3 ч при 100 °С. С помощью термостабильных амилaз можно осуществлять непрерывный процесс клейстеризации-расположения вплоть до температуры полной желатинизации крахмальных гранул. Совмещение разжижения и разваривания существенно повышает эффективность процесса.
Непрерывный гидрoлиз клейстеризующегося крахмала, переход продуктов реакции в раствор способствуют более быстрому набуханию крахмала во внутренних областях частиц сырья. За счет этого может быть сокращена продолжительность процесса, а его максимальная температура понижена до 110-1150С(температуры полной желатинизации крахмальных гранул).
Использование термостабильной амилазы существенно снижает расход фермента на единицу сырья. При замене «Амилoсубтилина ГЗx» на «Амилолихeтерм гЗx» дозировку амилазы можно уменьшить в 1,5 раза без снижения выхода спирта. Оптимальная доза «Амилолихeтерма» составила 1 ед./г крахмала: 03-- на стадии разжижения и 0.7- на стадии осахаривания (в сочетании с 6 ед./г глюкоaмлазы). Оптимальная доза «Амилосубтилина»- 1,5 ед./r крахмала (соответственно по стадиям 0.5 и 1,0 ед./г).
Ферментные препараты с относительно низкой оптимальной температурой действия целесообразно использовать на стадии осахаривания. Это относится к препаратам с основной активностью a-aмилазы (Aмилoсубтилин», «Амиолоризин, солод) и препаратам rпокоaмилазы. Амилолитический комплекс солода и грибная а-aмилаза более глубоко расщепляют крахмал, чем бактериальнaя а-амилаза, но полное осахаривание достигается только с помощью rлюкоaмилазы. Применение микробной глюкоaмилазы увеличивает степень сбраживания на13-15% по сравнению с вариантом осахаривания солодом.
В качестве препаратов глюкоaмилазы обычно применяют «Глюкавaморин Гх» или «Амилоглюкаваморин Гх»- культуральную жидкость гриба Asp. awamori. получаемую в ферментных цехах сnиртзаводов. Onтимум действия «Глюкаваморина» (pH 4-5.5) соответствует активной кислотности бражки (pH 4,2-5,2). Это важно, поскольку на стадии осахаривания сырья, в закрытой системе, где из сферы реакции не выводится глюкоза, процесс гидролиза крахмала проходит неполностью. Он продолжается в процессе брожения, по мере потребления глюкозы дрожжами, что сдвигает равновесие реакции гидролиза, катализируемой амилазой.
Общая продолжительность брожения зависит от дозировки глюкоaмилазы: продолжительность при 6 ед./г крахмала сырья брожение длится 72 при повышении дозы до 15 ед./г крахмала процесс заканчивается за 48 ч.
Применение микробной глюкоaмилазы дает возможность использовать солод того же вида зерна, что и в сырье (хотя это не допускается регламентом). Это показано в производственных опытах, проведенных на двух спиртзаводах, где осахаривание ячменного замеса проводили ячменным солодом и «глюкавамopином гх» (7,5% солода и 5 ед. rпокоамилaзы/г крахмала или 5% солода и 4 ед. глюкоaмилазы/r крахмала). При осахаривании зерновых замесов сочетанием солода и глюкоaмилазы соотношение этих компонентов влияет на органолептические свойства конечного продукта.
Из 30% ячменя и 70% пшеницы, разваренной при 142-145 °С, спирт смеси наилучшего качества будет получен при осахаривании 7,5% ячменного солода (в виде солодового молока) и «Глюкавамopина гх» в дозе гюкоaмилазы 3 ед/r крахмала. Для замеса из ячменя оптимальный состав oсахаривающей смеси - 5% солода и 4 ед гюкоaмилазы/г крахмала. В опытах использовали солод с активностью a-aмилазы 25-30 ед/r по капельному методу. Принимая во внимание колебания активности солода и качества сырья, необходимo проводить контрольные опыты по выбору наилучших осахаривающих композиций.
При приготовлении сусла в аппаратах гидродинамической обработки замесы нагревают лишь до 75-95 оC, что позволяет сохранить в недеградированном состоянии моносахара, аминокислоты, пептиды, органические кислоты, витамины и некоторую часть ферментативной активности. При низкотемпературной обработке замеса крахмал не может быть полностью клейстeризован, часть еrо остается «сырым». В этих условиях необходимо использовать ферментативные комплексы, способные воздействовать на сырой крахмал.
а-Амилаза некоторых штаммов В. subtilis гидролизует сырой крахмал на 28- 39%, в зависимости от источника крахмала. В сочетании с пюкoамиaзoй такая a-aмилаза гидролизует неклейстеризованный картофельный крахмал на 95%. Целесообразно исследовать осахаривающую способность комплексов a-амилазы и глюкоaмилазы из различных источников в отношении сырого крахмала, для реализации в низкотемпературной технологии спирта.