Файл: Сравнение структуры и свойств водородных соединений s и рэлементов i и iv групп.docx
Добавлен: 18.01.2024
Просмотров: 149
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
1. Свойства и строение атомов s- и p-элементов.
1.1. характеристика s-элементов.
1.2. Характеристика p-элементов
1.3. Сравнительная характеристика s- и p-элементов.
2. Структура и свойства s-элементов I группы периодической таблицы
2.1. Водород. Химические свойства водорода.
3. Структура и свойства s- и p-элементов IV группы периодической таблицы
3.1. Общие характеристики элементов группы IVA
6. Сравнение структуры и свойства водородных соединений s-элементов I и II групп.
Н2 → 2Н
Н2 + О2 = 2ОН
Н+ О2 = ОН+О
О+ Н2 = ОН+ Н
ОН+ Н2 = Н2О + Н
Взрывного процесса удается избежать, если работать с чистым водородом.
Поскольку для водорода характерна - положительная (+1) и отрицательная (-1) степень окисления, водород может проявлять и восстановительные, и окислительные свойства.
Более сильным восстановителем является атомарный водород. Он образуется из молекулярного в электронном разряде в условиях низкого давления.
Высокой восстановительной активностью обладает водород в момент выделения при взаимодействии металла с кислотой. Такой водород восстанавливает CrCl3 в CrCl2:
2CrCl3 + 2HСl + 2Zn = 2CrCl2+ 2ZnCl2 +H2↑
Важное значение имеет взаимодействие водорода с оксидом азота (II):
2NO + 2H2 = N2 + H2O
Используемое в очистительных системах при производстве азотной кислоты.
При взаимодействии с неметаллами водород проявляет восстановительные свойства:
Н2 (г) + Cl2 (г) = 2НCl (г), ΔH0298= - 184 кДж;
2Н2 (г) + О2 (г) = 2Н2О (г), ΔH0298= - 484 кДж.
Связи Н-Сl, Н-О прочные (имеют высокую энергию), поэтому реакции взаимодействия водорода с хлором и кислородо протекают с выделением большого количества тепла.
Поэтому водород проявляет восстановительные свойства по отношению ко многим оксидам, галогенидам, например:
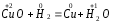 ,
, 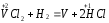
На этом основано применение водорода в качестве восстановителя для получения простых веществ из оксидов галогенидов.
В качестве окислителя водород взаимодействует с активными металлами:
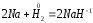 ;
; 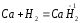
В данном случае водород ведет себя как галоген, образуя аналогичные галогенидам гидриды.
Гидриды s-элементов I группы имеют ионную структуру типа NaCl. В химическом отношении ионные гидриды ведут себя как основные соединения.
К ковалентным относятся гидриды менее электроотрицательных, чем сам водород неметаллических элементов, например, гидриды состава SiH4, ВН3, СН4. По химической природе гидриды неметаллов являются кислотными соединениями.
Характерной особенностью гидролиза гидридов является выделение водорода, реакция протекает по окислительно-восстановительному механизму.
Основной гидрид:
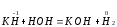
Кислотный гидрид:
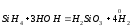
За счет выделения водорода гидролиз протекает полностью и необратимо (∆Н<0, ∆S>0). При этом основные гидриды образуют щелочь, а кислотные кислоту.
Стандартный потенциал системы
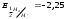 В. Следовательно, ион Н - сильный восстановитель.
В. Следовательно, ион Н - сильный восстановитель.В лаборатории водород получают взаимодействием цинка с 20% -й серной кислотой в аппарате Киппа.
Технический цинк часто содержит небольшие примеси мышьяка и сурьмы, которые восстанавливаются водородом в момент выделения до ядовитых газов: арсина SbH3 и стабина SbH. Таким водородом можно отравиться. С химически чистым цинком реакция протекает медленно из-за перенапряжения и хорошего тока водорода получить не удается. Скорость этой реакции увеличивается путем добавления кристалликов медного купороса, реакция ускоряется за счет образования гальванической пары Cu-Zn.[9]
3. Структура и свойства s- и p-элементов IV группы периодической таблицы
3.1. Общие характеристики элементов группы IVA
Четвертая большая группа периодической таблицы элементов, кроме элементов германия, олова, свинца (подгруппа германия), включает два общих элемента — углерод и кремний. Углерод — основа органической химии, главный органогенный элемент, неотъемлемая часть тела всего живого. Второй распространенный элемент — кремний — основной элемент неорганической химии и всей неживой природы. Основными полупроводниковыми материалами являются кремний и германий. Интегральные схемы из кремния и германия составляют основу компьютеров, микропроцессоров и т. д.
Все элементы этой подгруппы содержат четыре валентных электрона - электроны ns2np2. Такое количество валентных электронов оптимально для образования тетраэдрических связей по обменному механизму.[10]
Внутри IVA-группы существует зависимость свойств от положения элемента. Таким образом, у германия ЭЭО выше, чем у кремния, хотя первый потенциал ионизации у германия меньше. Это объясняется тем, что атом германия, в отличие от кремния, имеет заполненный внутренний уровень 3d10, который служит диафрагмой для β-электронов. В ряду C — Si — Ge — Sn — Pb энергия ионизации уменьшается, а радиус атома увеличивается, т. е. улучшаются свойства металла. Первые два элемента — типичные неметаллы, кремний и германий — полуметаллы. Свинец является типичным металлом. Все элементы проявляют степень окисления: +4, +2 и сверху вниз стабильность высокой степени окисления уменьшается, а низкой увеличивается. В соединениях со степенью окисления (+4) в порядке от углерода к свинцу окислительные свойства усиливаются, а в соединениях со степенью окисления (+2) - ослабляются. Например, германий и олово в окислительном состоянии (+2) являются сильными восстановителями, у соединений Ge (+2) восстановительные свойства настолько сильны, что в отсутствие окислителя они непропорциональны. Для свинца наиболее устойчива степень окисления (+2), а соединения свинца (+4) являются сильными окислителями.
Углерод (символ С — от латинского Carboneum) — элемент главной подгруппы группы 4, порядковый номер 6, электронное строение атома — 1s22s22p2. степени окисления в соединениях -4, +2, +4. Углерод известен с древних времен. Древесный уголь использовали для извлечения металлов из руд, алмазоподобных драгоценных камней. Гораздо позже графит стали использовать для изготовления баночек и карандашей.
В 1778 г. К. Шееле, нагревая графит с селитрой, обнаружил, что так же, как и при нагревании угля с селитрой, выделяется углекислый газ. Химический состав алмаза был определен в результате опытов А. Лавуазье (1772 г.) по горению алмаза на воздухе и исследований С. Теннанта (1797 г.), доказавшего, что одинаковое количество алмаза и угля дает одинаковое количество углекислого газа при окислении. Углерод был признан химическим элементом в 1789 году Лавуазье. Латинское название carboneum carbon произошло от carbo — уголь.
Соединения кремния, широко распространенные на Земле, известны человеку с каменного века. Использование каменных орудий для работы и охоты продолжалось тысячи лет. Использование соединений кремния в связи с их обработкой – производством стекла – началось около 3000 г. до н.э. э. (в Древнем Египте). Самым старым известным соединением кремния является SiO2 (кремнезем). В 18 веке кремнезем считался простым твердым телом и назывался «землей» (что также отражено в его названии).
Сложность состава кремнезема определил И. Я. Берцелиус. Он первым получил элементарный кремний из фторида кремния SiF4 в 1825 г., восстановив его металлическим калием. Новый элемент получил название «кремний» (от латинского silex). Русское название было введено Г.И. Гесс в 1834 году.
Сплавы олова с медью и бронзой были известны еще в 4 тысячелетии до нашей эры, а чистые металл во 2-м тысячелетии до н.э. е. В античном мире из олова изготавливали украшения, посуду и утварь. Происхождение названий «станнум» и «олово» не уточняется.
Олово — характерный элемент верхней части земной коры, его содержание в литосфере составляет 2,5·10-4 % по массе, в кислых изверженных породах 3·10-4 % и в более глубоких щелочных 1,5·10-4 % тем более олова в мантии. Концентрация олова связана как с магматическими процессами (известными как «оловянные граниты», обогащенные оловом пегматиты), так и с гидротермальными процессами. Из 24 известных минералов олова 23 образовались при высоких температурах и давлениях. Основное промышленное значение имеет касситерит SnO
2, меньше - станин Cu2FeSnS4. В биосфере олово мигрирует слабо, в морской воде его всего 3·10-7%; известные водные растения с высоким содержанием олова. Однако общей тенденцией геохимии олова в биосфере является дисперсия.
Свинец был известен 6-7 тысяч лет до нашей эры. е. народов Месопотамии, Египта и других стран древнего мира. Из него изготавливали скульптуры, предметы домашнего обихода, письменные доски. Римляне использовали свинцовые трубы для водопровода. Алхимики назвали Свинец Сатурном и назвали его знаком этой планеты. Соединения Свинец – «зола свинца» РbО, свинцовые белила 2РbСО3 • Рb(ОН)2 применялись в Древней Греции и Риме в качестве компонентов лекарств и красок. Когда было изобретено огнестрельное оружие, свинец стал использоваться в качестве материала для пуль. Токсичность свинца была зафиксирована еще в I веке нашей эры. е. Греческий врач Диоскорид и Плиний Старший.
Содержание свинца в земной коре (кларк) 1,6 • 10-3% мас. С образованием гидротермальных месторождений в основном связано образование в земной коре около 80 свинецсодержащих минералов (основной из которых — галенит PbS). В зонах окисления полиметаллических руд образуется ряд (около 90) вторичных минералов: сульфаты (англезит PbSO4), карбонаты (церусцит PbCO3), фосфаты [пироморфит Pb5(PO4)3Cl].
Свинец рассеян в биосфере, имеет низкое содержание живого вещества (5·10-5%), морской воды (3·10-9%). Свинец из природных вод частично сорбируется глинами и осаждается сероводородом, поэтому он накапливается в водорослях, загрязненных сероводородом, и в образованных из них черных глинах и сланцах.[11]
Таблица 2 – Свойства элементов подгруппы углерода
| Свойства | С | Si | Ge | Sn | Pb |
| Атомный радиус, нм | 0,077 | 0,118 | 0,139 | 0,158 | 0,175 |
| Ионный радиус Э-4, нм | 0,260 | 0,271 | 0,272 | 0,294 | 0,313 |
| Ионный радиус Э+4, нм | 0,015 | 0,041 | 0,053 | 0,071 | 0,084 |
| Потенциал ионизации I, В Э→Э0 + е | 11,26 | 8,15 | 7,899 | 7,344 | 7,417 |
| ОЭО | 2,6 | 1,9 | 2,0 | 1,8 | 1,7 |
| Ширина запрещенной зоны, ЭВ | 5,2 (алмаз) | 1,21 | 0,78 | 0,08 (-Sn) | _ |
| Температура плавления, 0С | 3247 | 1414 | 937 | 231,9 | 327,4 |
| Температура кипения, 0С | 3927 | 3249 | 2847 | 2337 | 1751 |
| Плотность, г/см3 | 3,51 (алмаз) | 2 | 5,72 | 6,7 | 9,8 |
| Е (Э3+р-р/Э), В | - | - | -0,2 | -0,136 | -0,126 |
| Степень окисления | -4,+2,+4 | 4,+2,+4 | -4,+2,+4 | -4,+2,+4 | +2,+4 |