ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 12.08.2024
Просмотров: 28
Скачиваний: 0
В ряду NO , NO, NO+ избыток связывающих электронов увеличивается, что приводит к возрастанию прочности связи и уменьшению её длины.
Метод молекулярных орбиталей
Двухцентровые молекулярные орбитали Многоцентровые молекулярные орбитали
При использовании метода молекулярных орбиталей считается, в отличие от метода валентных связей, что каждый электрон находится в поле всех ядер. При этом связь не обязательно образована парой электронов. Например, ион Н2+ состоит из двух протонов и одного электрона. Между двумя протонами действуют силы отталкивания (рис. 30), между каждым из протонов и электроном - силы притяжения. Химическая частица образуется лишь в том случае, если взаимное отталкивание протонов компенсируется их притяжением к электрону. Это возможно, если электрон расположен между ядрами - в области связывания (рис. 31). В противном случае силы отталкивания не компенсируются силами притяжения - говорят, что электрон находится в области антисвязывания, или разрыхления.
Двухцентровые молекулярные орбитали
В методе молекулярных орбиталей для описания распределения электронной плотности в молекуле используется представление о молекулярной орбитали (подобно атомной орбитали для атома). Молекулярные орбитали - волновые функции электрона в молекуле или другой многоатомной химической частице. Каждая молекулярная орбиталь (МО), как и атомная орбиталь (АО), может быть занята одним или двумя электронами. Состояние электрона в области связывания описывает связывающая молекулярная орбиталь, в области разрыхления - разрыхляющая молекулярная орбиталь. Распределение электронов по молекулярным орбиталям происходит по тем же правилам, что и распределение электронов по атомным орбиталям в изолированном атоме. Молекулярные орбитали образуются при определенных комбинациях атомных орбиталей. Их число, энергию и форму можно вывести исходя из числа, энергии и формы орбителей атомов, составляющих молекулу.
В общем случае, волновые функции, отвечающие молекулярным орбиталям в двухатомной молекуле, представляют как сумму и разность волновых функций атомных орбитале, умноженных на некоторые постоянные коэффициенты, учитывающие долю атомных орбиталей каждого атома в образовании молекулярных орбиталей (они зависят от электроотрицательности атомов):
φ(АВ) = с1ψ(А) ± с2ψ(В)
Этот метод вычисления одноэлектронной волновой функции называют "молекулярные орбитали в приближении линейной комбинации атомных орбиталей" (МО ЛКАО).
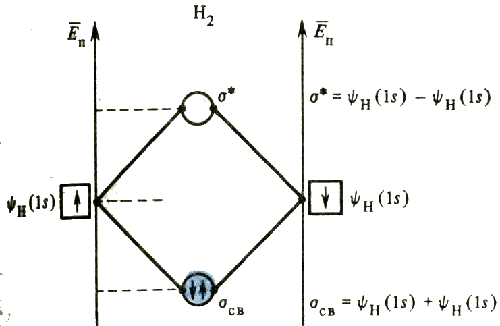
Так, при образовании иона Н2+ или молекулы водорода Н2 из двух s-орбиталей атомов водорода формируются две молекулярные орбитали. Одна из них связывающая (ее обозначают σсв), другая - разрыхляющая (σ*).
Энергии связывающих орбиталей ниже, чем энергии атомных орбиталей, использованных для их образования. Электроны, заселяющие связывающие молекулярные орбитали, находятся преимущественно в пространстве между связываемыми атомами, т.е. в так называемой области связывания. Энергии разрыхляющих орбиталей выше, чем энергии исходных атомных орбиталей. Заселение разрыхляющих молекулярных орбиталей электронами способствует ослаблению связи: уменьшению ее энергии и увеличению расстояния между атомами в молекуле. Электроны молекулы водорода, ставшие общими для обоих связываемых атомов, занимают связывающую орбиталь.
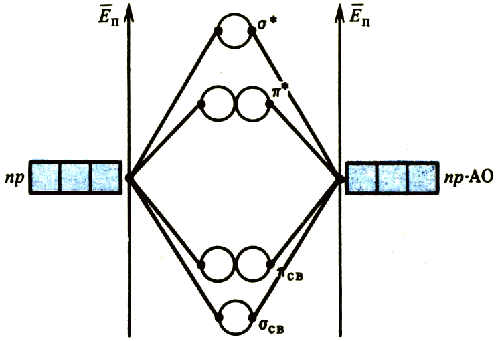
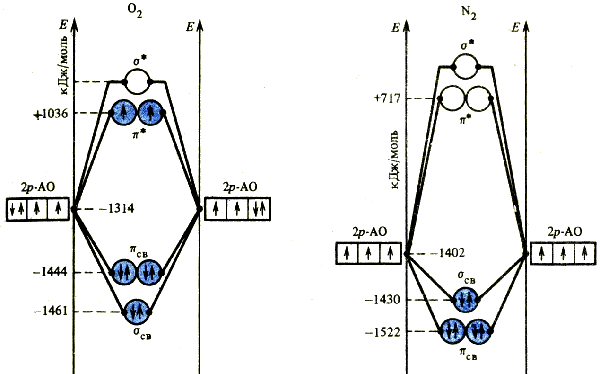
Комбинация р-орбиталей приводит к двум типам молекулярных орбиталей. Из двух р-орбиталей взаимодействующих атомов, направленных вдоль линии связи, образуются связывающая σсв- и разрыхляющая σ*-орбитали. Комбинации р-орбиталей, перпендикулярных линий связи, дают две связывающих π- и две разрыхляющих π*-орбитали. Используя при заселении электронами молекулярных орбиталей те же правила, что при заполнении атомных орбиталей в изолированных атомах, можно определить электронное строение двухатомных молекул, например O2 и N2 (рис. 35).
Из распределения электронов по молекулярным орбиталям можно рассчитать порядок связи (ω). Из числа электронов, расположенных на связывающих орбиталях, вычитают число электронов, находящихся на разрыхляющих орбиталях, и результат делят на 2n (в расчете на n связей):
ω = [N1(число e− на связывающих МО) − N2(число e− на разрыхляющих МО)] / 2 n
Из энергетической диаграммы видно, что для молекулы Н2 ω = 1.
Метод молекулярных орбиталей дает те же значения порядка химической связи, что и метод валентных связей, для молекул О2 (двойная связь) и N2 (тройная связь). В то же время он допускает нецелочисленные значения порядка связи. Это наблюдается, например, при образование двухцентровой связи одним электроном (в ионе Н2+). В этом случае ω = 0,5. Величина порядка связи прямо влияет на ее прочность. Чем выше порядок связи, тем больше энергия связи и меньше ее длина:
|
Молекула |
Порядок связи |
Энергия связи, кДж/моль |
Длина связи, пм |
|
O2 |
2 |
−498 |
121 |
|
N2 |
3 |
−945 |
110 |
Закономерности в изменениях порядка, энергии и длины связи можно проследить на примерах молекулы и молекулярных ионов кислорода.
Комбинация орбиталей двух разных атомов с образованием молекулы возможно только при близости их энергий, при этом атомные орбитали атома большей электроотрицательности на энергетической диаграмме всегда располагаются ниже.
Н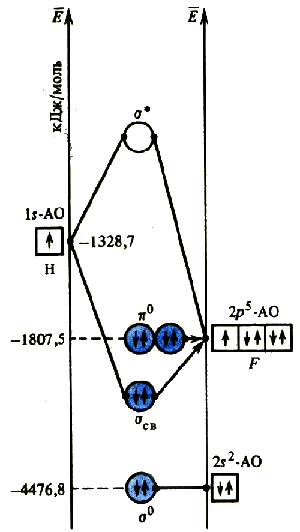 апример,
при образовании молекулы фтороводорода
невозможна комбинация 1s-АО
атома водорода и 1s-АО
или 2s-АО
атома фтора, так как они сильно различаются
по энергии. Ближе всего по энергии 1s-АО
атома водорода и 2p-АО
атома фтора. Комбинация этих орбиталей
вызывает появление двух молекулярных
орбиталей: связывающая σсв и
разрыхляющая σ*.
апример,
при образовании молекулы фтороводорода
невозможна комбинация 1s-АО
атома водорода и 1s-АО
или 2s-АО
атома фтора, так как они сильно различаются
по энергии. Ближе всего по энергии 1s-АО
атома водорода и 2p-АО
атома фтора. Комбинация этих орбиталей
вызывает появление двух молекулярных
орбиталей: связывающая σсв и
разрыхляющая σ*.
Оставшиеся 2р-орбитали атома фтора не могут комбинироваться с 1s-АО атома водорода, так как они имеют разную симметрию относительно межъядерной оси. Они образуют несвязывающие π0-МО, имеющие такую же энергию, что и исходные 2р-орбитали атома фтора.
Не участвующие в ЛКАО s-орбитали атома фтора образуют несвязывающие σ0-МО. Заселение электронами несвязывающих орбиталей не способствуют и не препятствуют образованию связи в молекуле. При расчете порядка связи их вклад не учитывается.
Многоцентровые молекулярные орбитали
В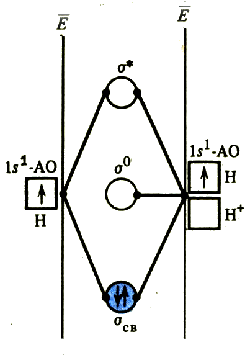 многоцентровых молекулах молекулярные
орбитали являются многоцентровыми, так
они представляют собой линейную
комбинацию орбиталей всех атомов,
участвующих в образовании связей. В
общем случае молекулярные орбитали не
локализованы, то есть электронная
плотность, отвечающая каждой орбитали,
более или менее равномерно распределена
по всему объему молекулы. Однако с
помощью математических преобразований
можно получить локализованные молекулярные
орбитали определенной формы, соответствующие
отдельным двух- или трехцентровым связям
или неподеленным электронам.
многоцентровых молекулах молекулярные
орбитали являются многоцентровыми, так
они представляют собой линейную
комбинацию орбиталей всех атомов,
участвующих в образовании связей. В
общем случае молекулярные орбитали не
локализованы, то есть электронная
плотность, отвечающая каждой орбитали,
более или менее равномерно распределена
по всему объему молекулы. Однако с
помощью математических преобразований
можно получить локализованные молекулярные
орбитали определенной формы, соответствующие
отдельным двух- или трехцентровым связям
или неподеленным электронам.
Простейшим примером трехцентровой связи служит молекулярный ион Н3+. Из трех s-орбиталей атомов водорода образуются три молекулярные орбитали: связывающая, несвязывающая и разрыхляющая . Пара электронов заселяет связывающую орбиталь. Образующаяся связь является двухэлектронной трехцентровой; порядок связи равен 0,5.
Химические частицы, содержащие неспаренные электроны, обладают парамагнитными свойствами (в отличие от диамагнитных свойств химических частиц, все электроны в которых спарены). Парамагнетиками являются все вещества, состоящие из химических частицы с нечетным числом электроном, например NO. Метод молекулярных орбиталей позволяет выявить парамагнетики среди веществ, состоящих из химических частиц с четным числом электронов, например О2, в молекуле которого два неспаренных электрона находятся на двух разрыхляющих π*-орбиталях.
Химические частицы с неспаренными электронами на внешних орбиталях называют свободными радикалами. Они обладают парамагнетизмом и высокой реакционной способностью. Неорганические радикалы с локализованными неспаренными электронами, например . Н, . NН2, обычно являются короткоживущими. Они образуются при фотолизе, радиолизе, пиролизе, электролизе. Для их стабилизации используют низкие температуры. Короткоживущие радикалы - промежуточные частицы во многих реакциях.