ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 28.09.2020
Просмотров: 4373
Скачиваний: 7
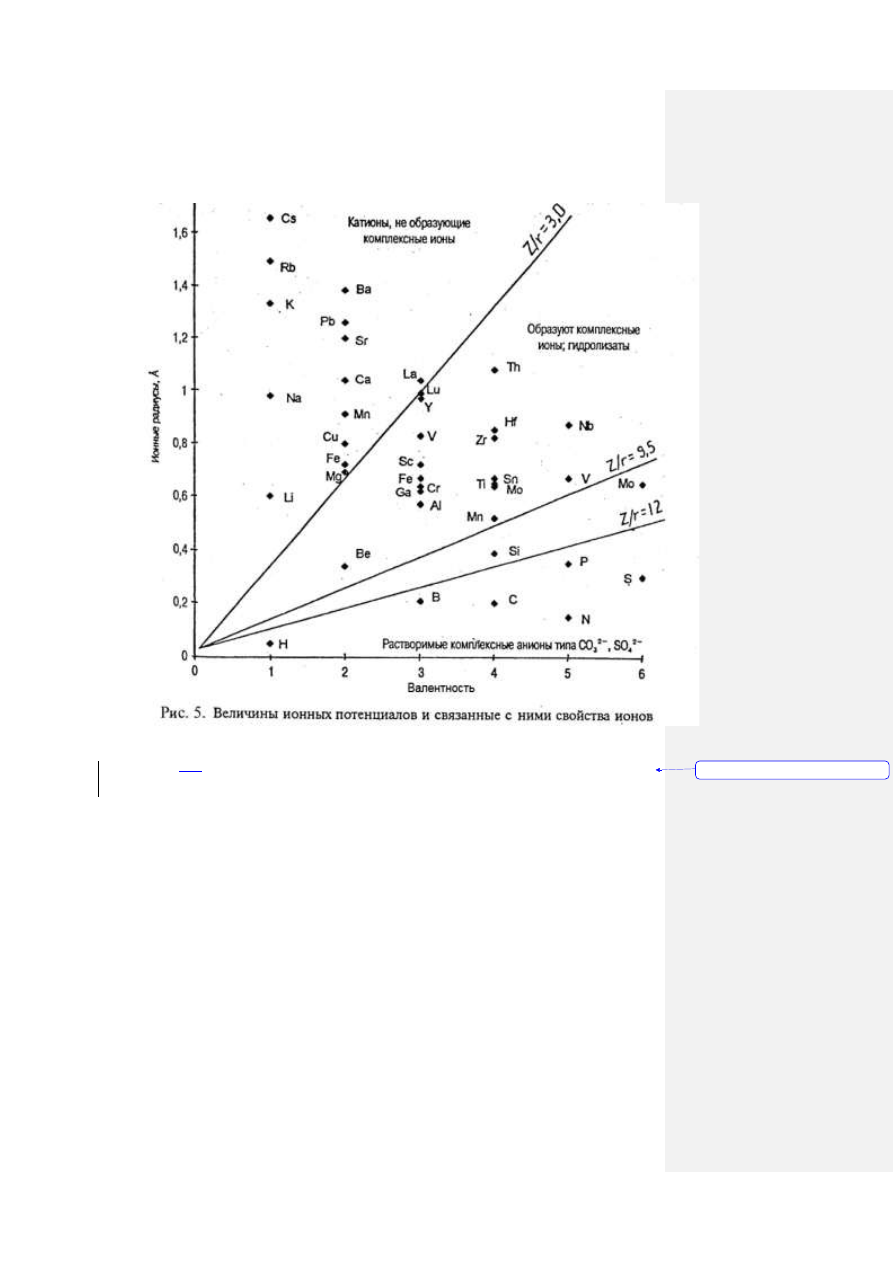
41
(по В.М.Гольдшмидту с дополнениями В.В.Щербины)
5.2.
Связь кларка с геохимическим поведением элементов
Химические элементы в системе распределяются по нормальному и логнор-
мальному закону или асимметрии. Поэтому для статистической обработки можно
использовать методы, основанные на теории вероятности.
Величина кларка определяет геохимию элемента в земной коре по закону
Гольдшмидта:
геохимия элемента в земной коре определяется как его химически-
ми свойствами, так и величиной его кларка
.
Например, элементы с одинаковыми
кларками ведут себя в земной коре по-разному (
Ga, Ni, Co, Sn, U
), а с разными
имеют сходство (
S
и
Se
,
Cu
и
Sr
).
В природе химические элементы вступают во взаимодействие не пропорци-
онально их массам, а в соответствии с количеством их атомов
. Поэтому разли-
чают массовые и атомные кларки (табл. 5).
Формат:
Список
42
Таблица 5
Атомные и массовые кларки элементов
Легкие элементы
Тяжелые элементы
Элемент
Массовый
кларк
Атомный
кларк
Элемент
Массовый
кларк
Атомный
кларк
O
47
58
U
2,5·10
-4
2·10
-5
Li
3,2·10
-3
1,9·10
-2
Au
4,3·10
-7
5·10
-8
Be
3,8·10
-4
1,2·10
-3
Ra
2·10
-10
9·10
-12
У легких элементов количество атомов большее при малой массе, у тяжелых
– большие массы при малом количестве атомов. Близкие по химическим свой-
ствам элементы резко различаются по кларкам:
Na–
2,50 %;
Rb
–1,5·10
-2
;
Li
–3,2·10
-
3
;
Cs–
3,7·10
-4
%. Разные по свойствам элементы имеют близкие кларки
: Mn
–0,1 и
Р
–0,093;
Rb–
1,5·10
-2
и
Cl–
·10
-2
. В земной коре преобладают легкие элементы до
железа включительно. Доминируют элементы с четными номерами по атомной
массе (86,43 %) как наиболее устойчивые, и очень мало их с нечетными номерами
(13,53 %). Особенно большие кларки имеют те элементы, атомная масса которых
делится на четыре:
O, Mg, S, Ca
и т.д. (рис. 6).
Среди атомов одного и того же элемента преобладают изотопы с массовым
числом кратным четырем, например:
16
О
– 99,76%;
17
О
– 0,04;
18
О
– 0,2;
32
S
–
95,01;
33
S
– 0,75;
34
S
– 4,22;
36
S
– 0,02. Элементы с четными порядковыми номера-
ми имеют большее число изотопов, чем с нечетными: № 50
Sn
– 10 изотопов; № 9
F
– 1 изотоп. В зависимости от генезиса элемента соотношение между изотопами
в природе будет разным и отличаться атомная масса. Это используется в геологии
как индикатор происхождения пород, например, атомная масса
Pb
207,21, в ура-
новых рудах – 206,1, в ториевых – 207,97. При этом химические свойства всех ви-
дов свинца одинаковые. Химический элемент устанавливают не по массе изотопа,
а по совокупности атомов с одинаковым положительным зарядом ядра. Среди
четных элементов, начиная с № 2 –
Не
, наибольшим кларком обладает каждый
шестой: №8
– О;
№14 –
Si
; №20 –
Ca
; №26 –
Fe;
№ 32 –
Ge
; № 38 –
Sr
и т.д. Ана-
логичное правило среди нечетных элементов, начиная с № 1 –
Н
: № 7 –
N
; № 13 –
Al;
№ 19 –
K
; № 25 –
Mg;
№ 31
– Ga;
№ 37 –
Rb
и т.д.
Редкие элементы мигрируют интенсивнее, чем близкие им по химическим
свойствам более распространенные. Поэтому редкие анионы (
CrO
4
2-
, SeO
4
2
-
) со-
единяются с распространенными катионами (
Ca, Mg, Fe
) и наоборот. «Химиче-
ское» поведние элемента отличается от «геохимического». Например,
S
и
Se
сходны по химическим свойствам, а в геохимии отличаются:
S
– ведущий элемент
многих процессов, образует руды, сульфиды, другие минеральные формы, для
Se
это нехарактерно.
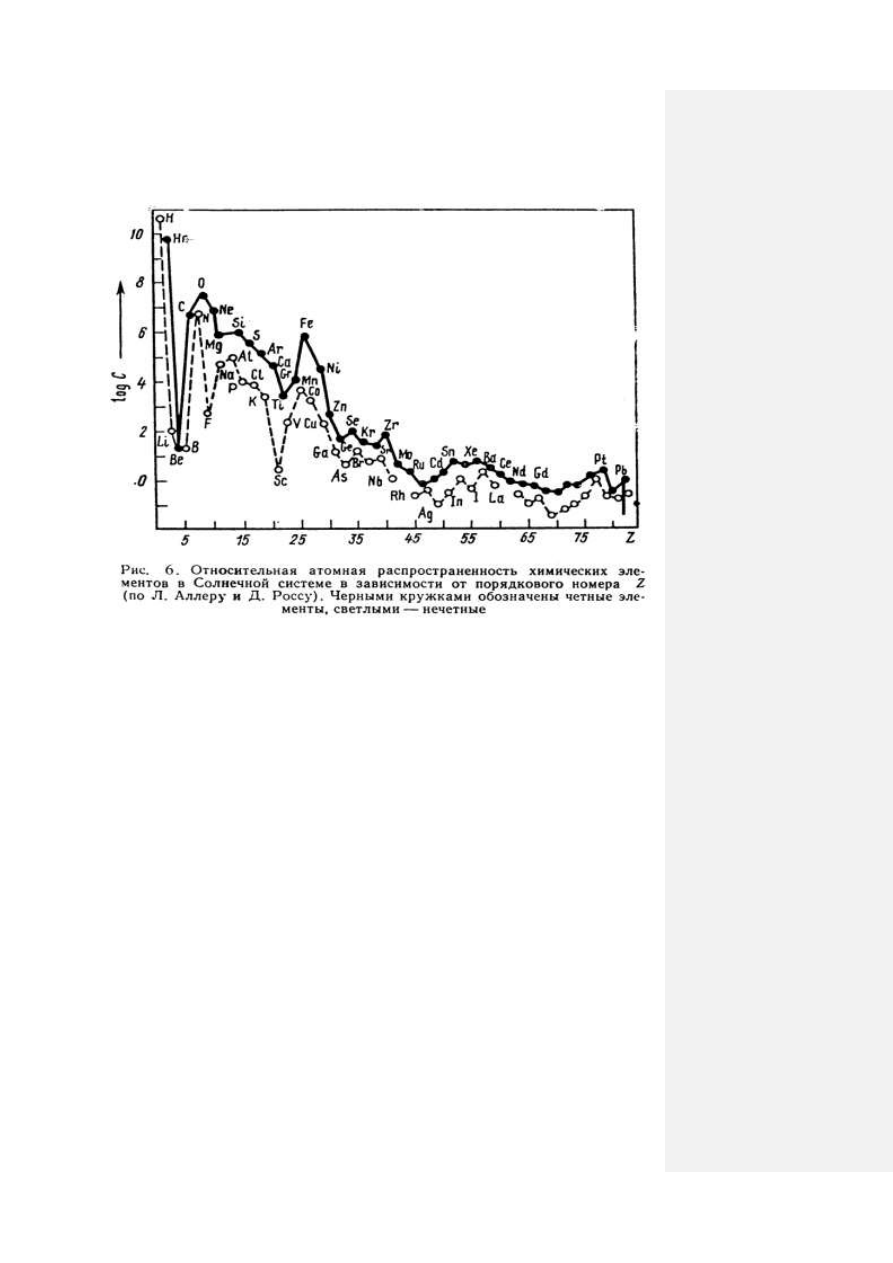
43
Ведущие элементы определяют геохимические особенности системы и вы-
ступают в роли
типоморфных элементов
или
геохимических диктаторов
. При-
мером может служить водород. При высоком его содержании в растворе среда
имеет кислую реакцию, которая разрушает минеральные соединения и переводит
их в миграционную форму. Кларк влияет на способность элементов образовывать
минералы.
Число минеральных видов элемента уменьшается с уменьшением его
кларка
. Например, при величине кларка от 1 до 10 % элемент может образовывать
до 239 соединений, при кларке 10
-5
–10
-6
% – всего до 23 минеральных видов. С
уменьшением кларков отсутствуют условия для концентрации элементов, труднее
достигаются произведение растворимости и выпадение самостоятельной фазы из
расплава.
Способность элементов к минералообразованию (
М
) определяются отноше-
нием числа минералов (
n
) данного элемента к его кларку (
К
) в земной коре
(табл. 6):
М=n / К
По Е.М. Квятковскому, элементы с большой способностью к минералообра-
зованию называются
минералофильными
(Si, C, Fe, Bi, Te, Se, U, S),
с малой –
ми-
нералофобными
(
Mg, Ba, Ga, Rb, Sr, In, Tl, TR
).
44
Таблица 6
Минералообразование элементов (по А.С. Поваренных, 1977)
Элемент
Кларк
(
К
)
Число минералов (
n
)
Способность к минерало-
образованию (
М
)
в земной
коре
в гипергенных
условиях
в земной
коре
в гипергенных
условиях
Cr
8,3·10
-3
17
6
2·10
3
7·10
2
Zn
8,3·10
-3
66
29
8·10
3
3,5·10
2
V
9·10
-3
61
10
6,8·10
3
1,1·10
3
Ni
5,8·10
-3
53
40
9,1·10
3
7·10
3
Число минеральных видов ограничивает смещение обменных равновесий,
подчиняющихся кристаллохимическим и термодинамическим законам, поэтому
широко распространены одни и отсутствуют другие виды.
Влияет изоморфизм, так как близость ионных радиусов при замещении не
всегда образует изоморфные смеси в случае большого различия электроотрица-
тельности (они не должны превышать разницы более 0,4). Например ионные ра-
диусы
Na
и
Cu
почти одинаковые, но велико различие по ЭО: Na
+
(r
o
=95 пм,
ЭО=0,9),
Cu
+
(r
o
=96 пм, ЭО=1,9), т.е. разница между элементами по ЭО составля-
ет 1,0. Однако пределы взаимной смесимости резко возрастают, если повышается
температура и давление, что соответствует гипогенным условиям. Часть элемен-
тов не образует собственные минеральные виды и входят в кристаллы распро-
страненных «идеальных изоморфных партнеров»:
Rb→K; Hf→Zn, Re→Mo.
Почти
1/3 всех стабильных элементов либо не образуют собственных минералов, либо
образуют очень редкие минералы в специфических условиях (высокое давление и
температура и др.):
Ge, Ga, Sc, Ta, Nb, Cd, In, Tl, Y,
платиноиды, редкие земли, т.е.
чем тяжелее элемент, тем меньше его минеральных видов. Некоторые космиче-
ские системы имеют близкие спектры по атомным кларкам (рис. 7). У каменных
метеоритов и Солнца кларки по большинству элементов сходны, за исключением
резких различий по
N, In, Re, B, C.
Атомные кларки кислых пород Земли пред-
ставлены в виде плавной ниспадающей кривой от водорода до палладия. Во всех
трех геохимических системах атомные кларки совпадают по
Si, Ti
, отчасти
V
.
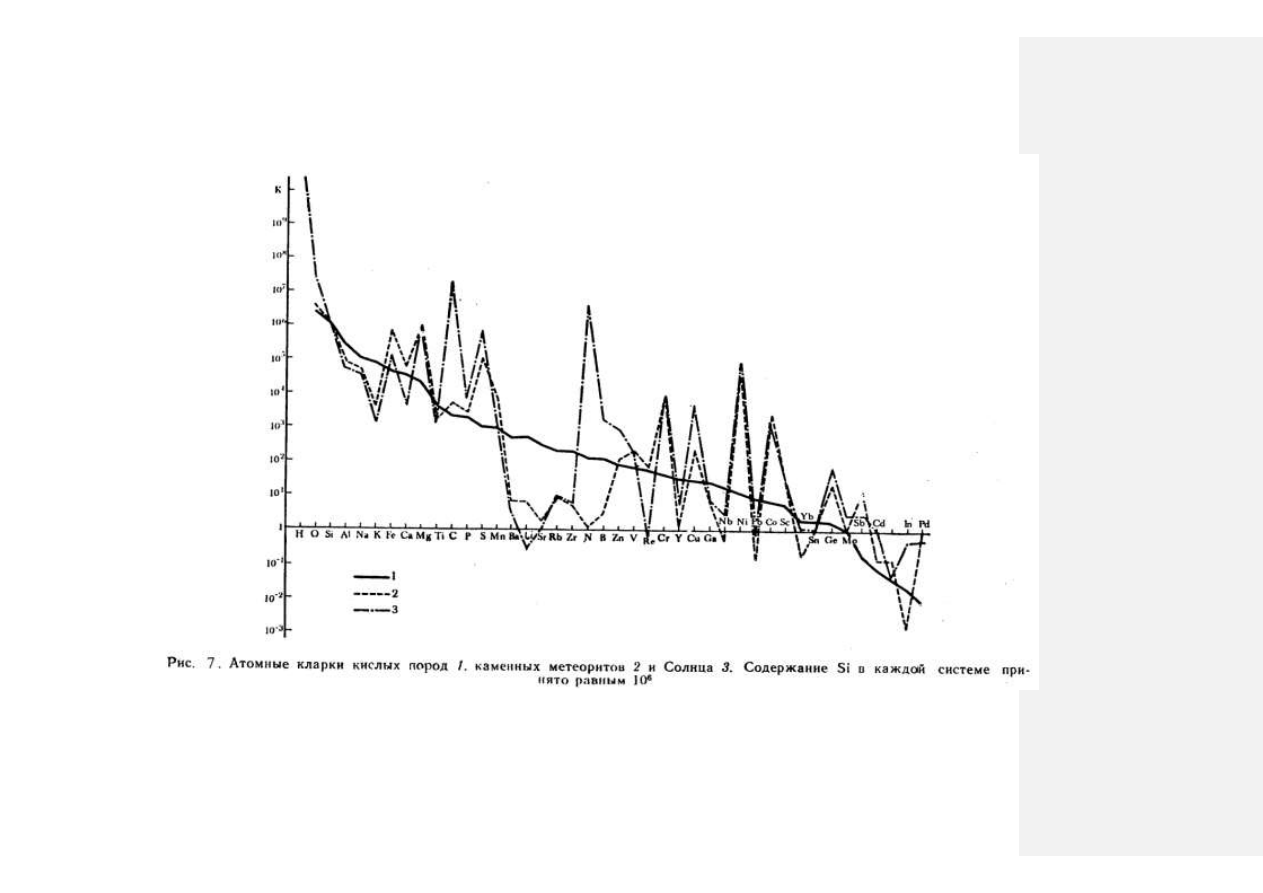
45