ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 24.10.2023
Просмотров: 983
Скачиваний: 87
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Входной контроль - 100% правильных ответов.
1. В молекуле воды реализуются химические связи ...
a. ионные
b. ковалентные неполярные
c. водородные
d. ковалентные полярные
2. Количество вещества для 56 г гидроксида натрия составляет _____ моль.
a. 0,6
b. 0,8
c. 1,4
d. 1,6
3. Степень окисления серы в соединении Na2S2O3 равна ...
a. +2
b. +6
c. +3
d. +4
4. Дихромовая кислота, азотистая кислота и гидроксид свинца (II) образуются из оксидов, приведенных в ряду ...
a. CrO3, N2O3, PbO2
b. Cr2O3, NO2, PbO
c. CrO3, N2O5, PbO
d. CrO3, N2O3, PbO
5. Среди приведенных веществ оксидом не является ...
a. CaO2
b. PbO2
c. NO2
d. CO2
6. Химический элемент, один из изотопов которого имеет массовое число атома 69 и содержит в ядре 40 нейтронов, - это ...
a. медь
b. кальций
c. галлий
d. цирконий
7. Аллотропными модификациями являются ...
a. оксид серы (IV) и оксид серы (VI)
b. протий и дейтерий
c. алмаз и графит
d. чугун и сталь
8. При взаимодействии оксида алюминия с оксидом серы (IV) образуется ...
a. тиосульфат алюминия
b. сульфит алюминия
c. сульфид алюминия
d. сульфат алюминия
9. В каком варианте соединения указаны в порядке: оксид, кислота, соль?
a. HNO3, N2O5, NH4OH
b. SO3, H2SO4, NaHSO4
c. ZnO, ZnCl2, H2S
d. Ca(OH)2, CaO, CaSO4
10. При растворении 6 моль алюминия в избытке соляной кислоты выделяется _____молей газообразного водорода.
a. 3
b. 8
c. 9
d. 6
Тест 1. Классификация неорганических соединений – 93,3% правильных ответов
1. Какой из указанных гидроксидов проявляет более основные свойства?
a. Sr(OH)2
b. Ca(OH)2
c. Ba(OH)2
d. Mg(OH)2
2. В порядке: соль, основание, оксид соединения указаны в варианте ...
a. FeO, FeCl2, H2SiO3
b. Cu(HSO4)2, Cu(OH)2, CO2
c. P2O5, H2CO3, NH4Cl
d. PbCl2, H3PO4, KHCO3
3. Кислые соли не может образовывать ни одна из кислот, приведенных в ряду ...
a. HCl, H2S, HBr
b. HClO4, НСN, CH3COOH
c. HNO3, HMnO4, H3PO4
d. HNO2, H2SO4, H2SiO3
4. Установите соответствие между формулой вещества и реагентами
, с каждым из которых это вещество может взаимодействовать.
| H3PO4 Cr2O3 CO2 Na2CO3 |
|
5. Какая из приведенных пар веществ будет взаимодействовать между собой?
a. CaO и Na2O
b. H2SO4 и H3PO4
c. Mg(OH)2 и KOH
d. BaO и CO2
6. Хлорид калия может взаимодействовать с ...
a. CaSO4
b. AgNO3
c. Pb(CH3COO)2
d. Fe(OH)3
7. Установите соответствие между названием вещества и классом неорганических соединений.
| гидрокарбонат кальция гидроксид калия гидроксид олова (II) оксид алюминия |
|
8. При взаимодействии оксида кальция с оксидом углерода (IV) образуется ...
a. гидроксид кальция
b. карбид кальция
c. ацетат кальция
d. карбонат кальция
9. Металл, который образует оксиды трех типов (основной, кислотный, амфотерный), - это ...
a. свинец
b. хром
c. медь
d. олово
10. Гидроксид цинка, гипохлорит натрия, гидрокарбонат кальция - это соответственно ...
a. амфотерное основание, нормальная соль, кислая соль
b. основание, нормальная соль, основная соль
c. основание, кислая соль, кислая соль
d. щелочь, кислая соль, основная соль
11. Какой из приведенных оксидов может проявлять кислотные свойства?
a. NiO
b. Al2O3
c. Na2O
d. Y2O3
12. Среди перечисленных веществ: Li2O, BeO, B2O3, CO2, N2O, SiO2, Mn2O7, BaO, Cr2O3, CaO2 - число основных и кислотных оксидов соответственно равно ...
a. 4 и 4
b. 3 и 4
c. 3 и 3
d. 2 и 4
13. Какая из приведенных кислот является более сильной?
a. H2SO4
b. H3PO4
c. H2SO3
d. H2CO3
14. Установите соответствие между формулой вещества и классом неорганических соединений.
| NH4NO2 NH4OH (CuOH)2CO3 NaHSO3 |
|
15. С чем может взаимодействовать Zn(OH)2?
a. CuCO3
b. NaOH
c. НСl
d. CO2
Тест 2. Строение вещества – 100% правильных ответов
1. На нейтрализацию 9,8 г ортофосфорной кислоты израсходовано 8 г NаОН. Формула образующейся соли имеет вид...
a. Na2PO4
b. NaH2PO4
c. Na2HPO4
d. Na3PO4
2. При взаимодействии 10,64 г трехвалентного металла с кислотой выделяется 4,02 л водорода (н.у.). Определите металл.
a. P
b. Y
c. Al
d. Fe
3. Молярная масса эквивалентов фосфорной кислоты в реакции:
H3PO4 + 2NaOH = Na2HPO4 + H2O
равна ...
a. 24,5
b. 32,7
c. 98
d. 49
4. Установите соответствие эквивалента для гидроксида хрома в приведенных реакциях
Cr(OH)3 + 3HNO3 = Cr(NO3)3 + 3H2O
Cr(OH)3 + HNO3 = Cr(OH)2NO3 + H2O
Cr(OH)3 + 2HNO3 = CrOH(NO3)2 + 2H2O
5. При нормальных условиях эквивалентные объемы кислорода и водорода составляют ...
a. 11,2 л О2 и 22,4 л Н2
b. 22,4 л О2 и 11,2 л Н2
c. 11,2 л О2 и 11,2 л Н2
d. 5,6 л О2 и 11,2 л Н2
6. Молярная масса эквивалента металла равна 12 г/моль. Молярная масса эквивалентов оксида этого металла составляет ...
a. 24 г/моль
b. невозможно вычислить
c. 20 г/моль
d. 18 г/моль
7. Фосфор образует два различных по составу хлорида. В этих соединениях эквивалент сохраняется постоянным для элемента ...
a. хлора
b. ни для одного из этих элементов
c. фосфора и хлора
d. фосфора
8. При сгорании неизвестного металла массой 5 г образуется 9,44 г оксида этого металла. Определите металл.
a. Mg
b. F
c. Be
d. Al
9. На восстановление 1,80 г оксида неизвестного металла израсходовано 883 мл водорода, измеренного при нормальных условиях. Определите металл.
a. Ni
b. Al
c. N
d. Sc
10. На восстановление оксида неизвестного металла массой 7,2 г потребовалось 2,24 л водорода, измеренного при нормальных условиях. Определите металл.
a. Cu
b. Fe
c. Si
d. Zn
11. Гидроксид натрия массой 8 г вступает в реакцию с 9,8 г ортофосфорной кислоты. Определите формулу образующейся соли.
a. Na3PO3
b. Na3PO4
c. NaH2PO4
d. Na2HPO4
12. Определите молярную массу эквивалентов азота в молекуле аммиака NH3.
a. 8,5
b. 5,7
c. 4,25
d. 14
Тест 3. Строение вещества –
90,8% правильных ответов
1. Какая электронная формула отвечает иону Cl–:
a. 1s22s22p63s23p64s2
b. 1s22s22p63s23p4
c. 1s22s22p63s23p5
d. 1s22s22p63s23p6
2. Какое строение внешнего энергетического уровня имеет возбужденный атом кремния:
a. 3s13p13d2
b. 3s23p2
c. 3s23p24s2
d. 3s13p3
3. Установите соответствие между формулой молекулы и типом гибридизации валентных орбиталей центрального атома молекулы
sp2-гибридизация
sp-гибридизация
sp3-гибридизация
-
SO2 -
BeF2 -
Cl2 -
H2O -
NaCl
4. На энергетической диаграмме распределения электронов в основном состоянии атома
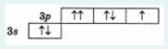
нарушается …
a. принцип минимума энергии
b. принцип Паули
c. правило Клечковского
d. правило Гунда
5. Формула вещества, в молекуле которого содержится одинаковое число σ- и π-связей, имеет вид…
a. HClO4
b. CO2
c. HNO3
d. Н2O
6. Линейную форму имеет молекула:
a. H2O
b. OF2
c. H2S
d. MgCl2
7. Число неспаренных электронов в основном состоянии атома элемента, образующего летучее водородное соединение состава ЭН, равно…
a. 5
b. 3
c. 7
d. 1
8. Установите соответствие между формулой вещества и типом химической связи, реализуемом в молекуле вещества
ковалентная неполярная
ковалентная полярная
ионная
-
Na3PO4 -
H3PO4 -
NaCl -
P4
9. Наибольшее число π-связей содержится в молекуле…
a. SiO2
b. O2
c. N2
d. P4
10. Основное состояние атома меди отвечает электронной формуле 1s22s22p63s23p64s13d10. Значение какого квантового числа обозначено буквой d:
a. магнитного
b. главного
c. орбитального
d. спинового
11. Какую максимальную валентность может проявлять железо в своих соединениях:
a. 6
b. 2
c. 4
d. 3
12. Из числа предложенных электронных конфигураций укажите невозможную:
a. 4p5
b. 2p1
c. 2s3
d. 3d2
13. Установите соответствие между формулой вещества и типом кристаллической решетки, которой обладает вещество
молекулярная
атомная
ионная
-
SiO2 -
CO2 -
СaCl2 -
N2
14. Одинаковое число нейтронов содержится в ядрах атомов изотопов ...
a.

b.

c.

d.
15. На энергетической диаграмме распределения электронов в основном состоянии атома
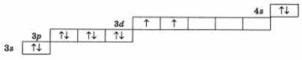
...
a. нарушено правило Гунда
b. нарушен принцип минимума энергии
c. нарушен принцип Паули
d. нарушений нет
16. Наибольшее число неспаренных электронов имеет атом ...
a. марганца
b. мышьяка
c. железа
d. хрома
17. При перекрывании каких атомных орбиталей образуется молекула Сl2:
a. d
b. s
c. f
d. p
18. Установите соответствие между формулой вещества и геометрической формой молекулы
плоская треугольная молекула
линейная молекула
тетраэдрическая молекула
-
NH3 -
SF6 -
СаF2 -
HNO3
19. Сколько свободных d-орбиталей у атома ванадия в свободном состоянии:
a. 3
b. 4
c. 2
d. 1
20. Укажите тип химической связи в молекуле BaSO4:
a. ковалентная неполярная
b. ковалентная полярная
c. ионная
d. водородная
Тест 4. Химическая термодинамика – 100% правильных ответов
1. Для самопроизвольного протекания реакции необходимо условие:
a. ΔG < 0
b. ΔH > 0
c. ΔG > 0
d. ΔH < 0
2. Энтальпия образования Na2SO4 соответствует тепловому эффекту реакции:
a. 2Na + S +2O2 = Na2SO4
b. Na2O + S + 3/2O2 = Na2SO4
c. 2Na + SO2 + O2 = Na2SO4
d. Na2O + SO3 = Na2SO4
3. В какой из приведенных реакций выделится больше теплоты?
a. N2(г) + O2(г) →2NO(г), ΔH= 180,0 кДж
b. S(т) +О2(г) → SO2(г), ΔH= -297 кДж
c. Na(т) + ½Cl2(г) → NaCl(т), ΔH= -411 кДж
d. NaI(т) → Na(т) + ½I2(г) , ΔH = 288 кДж
4. В процессе испарения вещества его энтропия