ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 26.10.2023
Просмотров: 168
Скачиваний: 8
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
2. hs диаграмма водяного пара

3. hd диаграмма влажного воздуха

11. Термодинамика процессов истечения газов и паров: первый закон термодинамики для потока, располагаемая работа, преобразование энергии газового потока в работу, определение скорости и расхода газа или пара, получение сверхзвуковых скоростей, влияние трения на процесс истечения.



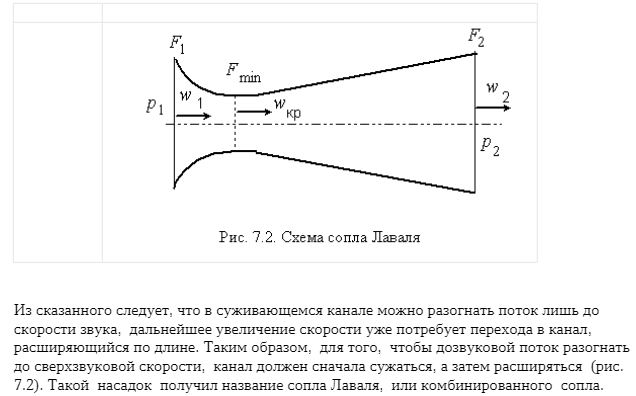
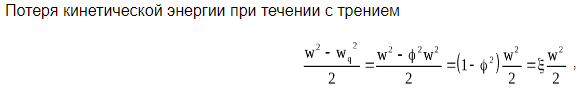
12. Обратимые и необратимые процессы. Потери работоспособности вследствие необратимости. Энтропия как мера необратимости.
Самопроизвольные необратимые процессы, протекающие в изолированной системе, всегда стремятся привести эту систему в состояние равновесия. Рассмотрим, как при стремлении изолированной системы к внутреннему равновесию меняется количество работы, которое может быть произведено внутри системы.
Воспользуемся схемой, то есть предположим, что внутри системы имеются два тела с различными температурами и ( ). Наличие в системе двух тел с разной температурой позволяет получить работу, если использовать первое тело как источник теплоты в цикле теплового двигателя, а второе – как ее приемник. Для получения максимально возможной работы за счет заданного количества теплоты , забираемой у первого тела, необходимо осуществлять в двигателе обратимый цикл Карно, то есть такой цикл, в котором температура рабочего тела в изотермическом процессе подвода теплоты равна температуре источника теплоты, а в изотермическом процессе отвода теплоты – температуре приемника теплоты.
Термический КПД цикла Карно можно выразить так:
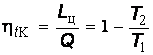
, (6.11)
откуда
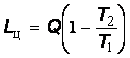 . (6.12)
. (6.12) Предположим теперь, что тела приведены в непосредственное соприкосновение и вследствие самопроизвольного необратимого теплообмена между ними температура первого тела понизилась до , а температура второго повысилась до . Если теперь вновь использовать рассматриваемые тела в качестве источника и приемника теплоты в обратимом цикле Карно, то работа , совершаемая в цикле, будет равна
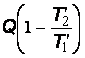 . Так как и , то очевидно, что . Следовательно, в результате необратимого процесса теплообмена между телами внутри изолированной системы и выравнивания их температур количество работы, которое может быть произведено в этой системе, уменьшилось. Если в результате необратимого теплообмена температуры тел станут одинаковыми, то есть в системе установится равновесие, то работа за счет теплоты в такой системе произведена быть не может.
. Так как и , то очевидно, что . Следовательно, в результате необратимого процесса теплообмена между телами внутри изолированной системы и выравнивания их температур количество работы, которое может быть произведено в этой системе, уменьшилось. Если в результате необратимого теплообмена температуры тел станут одинаковыми, то есть в системе установится равновесие, то работа за счет теплоты в такой системе произведена быть не может.Суммарная энергия изолированной системы остается постоянной при любых протекающих в системе процессах. Обесценивание энергии, то есть потеря ею работоспособности, нарастает по мере приближения изолированной системы к состоянию равновесия. При достижении системой равновесия, когда ее энтропия достигает максимума, система полностью теряет запас работоспособности. Применительно к земным условиям сказанное выше означает, что работу за счет энергии различных тел можно получать лишь в том случае, если эти тела не находятся в равновесии с окружающей средой, имеющей температуру . Потеря работоспособности вследствие необратимости процессов, протекающих в этих условиях, может быть найдена по формуле Гюи-Стодолы:
, (6.13)
где – изменение энтропии системы, обусловленное необратимостью протекающих процессов.
Как видно из формулы (6.13), потеря работоспособности пропорциональна приращению энтропии из-за необратимости процессов. Следовательно, это приращение энтропии может быть мерой степени необратимости.
Степень необратимости многих технически важных процессов, например процессов сжатия газов, относительно невелика, и эти процессы можно приближенно рассматривать как обратимые, используя для анализа методы термодинамики. Вместе с тем отметим, что существуют так называемые предельно необратимые процессы, в которых вся потенциально возможная работа, соответствующая наблюдаемому изменению параметров, обращается из-за необратимости в ноль. Примерами таких процессов являются диффузия и теплообмен при конечной разности температур.
Энтропия (S)- термодинамическая функция состояния, которая служит мерой беспорядка системы.
S = Q/T S[Дж/К], S[Дж/(Моль*К)]
∆S>0 – реакция необратимая
∆S=0 – реакция обратимая
13. Работоспособность термодинамических систем. Понятие эксергии. Эксергия теплоты, потока вещества, химическая (нулевая) эксергия.
Энергия в ходе необратимых процессов, оставаясь количественно неизменной, ухудшается качественно. В настоящее время в термодинамике качество энергии количественно оценивают величиной эксергии . Эксергия – это та часть энергии, которая может быть преобразована в работу при обратимом переходе системы в равновесие с окружающей средой при условии, что окружающая среда является единственным источником или приемником теплоты и вещества. Ту часть энергии системы, которая при данных условиях окружающей среды не может быть преобразована в работу, называют анергией . Таким образом, в общем случае
. (6.14)
Необратимые процессы приводят к переходу эксергии в анергию, то есть к безвозвратным потерям эксергии. Чем выше степень необратимости протекающих процессов, тем эти потери больше.
По мере приближения системы к равновесию , а . Иначе говоря, вся энергия системы, пришедшей в равновесие, переходит в анергию, и использовать ее для производства работы невозможно.
Выше было сказано о том, что для вывода системы из состояния равновесия и осуществления процессов, протекающих в противоположенном естественному направлении, необходимо воздействие на систему извне. Например, можно организовать передачу теплоты от более холодного тела более нагретому с помощью холодильной машины. Можно с помощью насосов поднять жидкость на нужную высоту и т. п. Однако все эти процессы реализуются только за счет эксергии окружающей среды. Как только эта эксергия иссякнет, процессы в рассматриваемой системе потекут естественным путем в сторону установления равновесия.
Эксергия потока вещества определяется двумя составляющими: физической (термомеханической) и химической (нулевой) эксергией. Для вещества, находящегося в потоке, эксергии соответствует техническая работа, равная работе изменения давления в потоке при протекании в системе только обратимых процессов, т.е. располагаемой работе, при переходе вещества из начального состояния в состояние равновесия с окружающей средой. Тогда из уравнения первого закона термодинамики для потока получим, что эксергия вещества в потоке равна
e = h –h0–T0(s –s0)
Эксергия
теплоты: eq =q*(1-To/T)
где q– теплота, Дж;
Т – температура рабочего тела, К;
То– температура окружающей среды, К.
Эксергия работы: el =L
где L– термомеханическая энергия;
еl – химическая энергия.
Эксергия теплоты- максимально возможная работа, которую можно получить изтеплотыпри условии, что теплоприемником является окружающая среда.
Нулевая химическая эксергия Е0 ‒ это максимальная работа, которая может быть получена в результате обратимой химической реакции при установлении термодинамического равновесия между продуктами реакции и теми же продуктами в окружающей среде при условии, что исходные и конечные продукты реакции имеют такие же значения температуры и давления, что и в окружающей среде.
14. Эксергетический метод анализа. Его преимущества и недостатки.
Метод энергетических балансов дает ответы на вопросы о том, какое количество теплоты, введенной в печь, использовано для достижения поставленной технологической цели и сколько для этого требуется топлива или электроэнергии. Рассматривая составляющие теплового баланса, можно найти те потери, устранение которых позволяет повысить эффективность использования топлива. Вместе с тем, определяемая в результате энергетического анализа доля полезно использованной энергии не позволяет судить о том, насколько рационально используется в анализируемом устройстве качество энергии. Такую оценку можно сделать лишь на основе термодинамического анализа, выполненного энтропийным или эксергетическим методом.
Под качеством энергии понимают возможность получения за счет нее работы, а количественной мерой качества энергии служит эксергия. Различают эксергию потока вещества, эксергию потока теплоты, химическую эксергию, эксергию вещества в замкнутом объеме, эксергию излучения и т. д. Для термодинамического анализа металлургических установок значение имеют в основном три первых вида эксергии.
Эксергию потока вещества, поступающего в установку или уходящего из нее за единицу времени, определяют по формуле
где и , и – соответственно значения энтальпии и энтропии вещества в потоке и при параметрах окружающей среды; – температура окружающей среды; – массовый расход вещества в потоке.
Эксергию потока теплоты, забираемой у тела с температурой , находят на основе того, что максимальная работа за счет нее может быть получена в обратимом цикле Карно, в котором приемником теплоты является окружающая среда. Умножая количество теплоты на КПД цикла Карно, получают
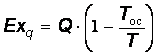 . (20.26)
. (20.26)Химическую эксергию топлива находят приближенно по величине низшей теплоты сгорания:
В ходе анализа эксергетическим и энтропийным методами составляется эксергетический баланс и на его основе определяется эксергетический КПД:
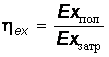 , (20.28)
, (20.28)где – полезно использованная эксергия; – затраченная эксергия.
Баланс эксергии является условным, так как эксергия во всех реальных необратимых процессах безвозвратно теряется и, следовательно, суммарная эксергия потоков вещества и энергии на выходе всякого устройства меньше, чем на входе. Для получения равенства к эксергии на выходе добавляют ее суммарные потери :
. (20.29)
Эксергетический баланс записывают также в виде
Из сопоставления последнего равенства с выражением (20.28) следует, что
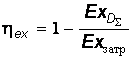 , (20.31)
, (20.31)то есть чем больше безвозвратные потери эксергии, тем ниже эксергетический КПД.
Подчеркнем, что потери эксергии – результат необратимого протекания процессов и, чем выше степень необратимости, тем эти потери больше. Например, чем больше в нагревательных печах разница в температурах греющей среды и нагреваемого тела, тем больше при этом потеря эксергии. Напротив, чем меньше потери эксергии, тем полнее реализуется запас работоспособности потоков вещества и энергии, тем полнее выбранный способ использования энергии соответствует ее качеству. По этой причине надо стремиться к снижению потерь эксергии, если это не противоречит целям технологического процесса.
Различия в эксергетическом и энтропийном методах анализа заключаются, главным образом, в способе вычисления потерь эксергии. В эксергетическом методе эти потери находят, вычитая из величины эксергии на входе ее величину на выходе. При энтропийном методе определение потерь эксергии основано на законе Гюи–Стодолы. Согласно этому закону оп в любом необратимом процессе могут быть выражены произведением приращения энтропии вследствие необратимости процессов на температуру окружающей среды: