Файл: национальный исследовательский томский политехнический университет практическое задание.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.10.2023
Просмотров: 29
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное автономное образовательное учреждение высшего образования
«НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ
ТОМСКИЙ ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
ПРАКТИЧЕСКОЕ ЗАДАНИЕ
| № 1 |
| (номер работы) |
| Дисциплина: | Химия 1.2 |
| | (наименование дисциплины) |
| Студент: | З-5А21 | Кривошеин Е.В. | 05.05.2023 |
| | (номер группы) | (фамилия, инициалы) | (дата сдачи) |
| Преподаватель: | | Князева Е.М. | |
| | | (фамилия, инициалы) | |
| Томск – | 2023 |
| (город, год) | |
Задание 1. Сформулируйте правило Дюлонга-Пти. Запишите его математическое выражение. Почему данное правило называют эмпирическим? С помощью каких физико-химических методов можно определить атомную массу элементов в настоящее время? Определите неизвестный металл, если 20 г его соединяется с 3,426 л кислорода (н. у.). Удельная теплоемкость металла равна 0,39 Дж/(гК).
Решение: 1.1) Правило Дюлонга-Пти: атомные теплоёмкости простых твёрдых веществ примерно одинаковы и составляют приблизительно 25 Дж/(мольК).
Атомная теплоемкость вещества определяется количеством колебаний, которое может совершать атом в кристаллической решетке, в трехмерной решетке число таких колебаний равняется трём, а каждому колебанию соответствует энергия, равная R=8,314 Дж/(мольК). Отсюда математическая формула закона:
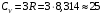 Дж/(мольК)
Дж/(мольК)где CV – атомная теплоемкость при постоянном объёме.
Альтернативная формулировка: произведение удельной теплоемкости простого твердого вещества на его атомную массу является величиной приблизительно постоянной и равной 25 Дж/(мольК). Математическая формулировка:
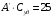 Дж/(мольК)
Дж/(мольК)1.2) Правило Дюлонга и Пти было сформулировано на основе экспериментальных данных, поэтому оно является эмпирическим (эмпирическим называют что-либо, полученное опытным путём).
1.3) В настоящее время атомные массы элементов можно определить с помощью масс-спектроскопии (используется для определения массовых чисел отдельных изотопов) и методов рентгенографии.
1.4.1) Решение задачи. Определим неизвестный металл. Сперва вычислим массу кислорода, с которой соединяется неизвестный металл. Комбинируя формулы (а) и (б), получаем необходимое выражение:
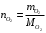 (а)
(а)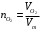 (б)
(б)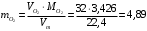 г
гПримечание:
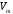 - молярный объём, равный 22,4 л/моль.
- молярный объём, равный 22,4 л/моль.1.4.2) Применим закон эквивалентов (в) и определим эквивалентную массу металла:
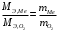 (в)
(в)Эквивалентная масса кислорода выражается формулой:
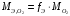 ,
,а фактор эквивалентности простого вещества равен:
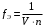 ,
,где
 - число атомов элемента в молекуле;
- число атомов элемента в молекуле; 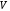 - валентность элемента. Поэтому для кислорода:
- валентность элемента. Поэтому для кислорода: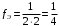
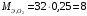 г/моль
г/мольПодставляем численные значения в формулу (в):
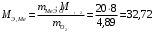 г/моль
г/моль1.4.3) По закону Дюлонга-Пти найдём приблизительную атомную массу металла:
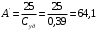 г/моль
г/моль1.4.4) Теперь зная приблизительную атомную и эквивалентную массу металла, рассчитываем его валентность, не забывая, что она имеет целочисленные значения:
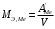
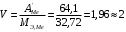
1.4.5) Уточняем атомную массу, умножая эквивалентную массу на валентность:
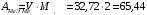 г/моль
г/моль1.4.6) Данному значению атомной массы, согласно Периодической системе, соответствует цинк Zn – двухвалентный металл побочной подгруппы II группы.
Ответ: неизвестный металл – цинк.
Задание 2. Сформулируйте основные положения атомно-молекулярного учения. Какие учёные внесли вклад в его развитие? Приведите примеры веществ с молекулярной и немолекулярной структурой. Определите эквивалентную и атомную массу металла, если при восстановлении 8 г оксида металла (III) израсходовано 3,36 л водорода (н. у.).
Решение: 2.1) Можно выделить следующие положения атомно-молекулярного учения:
-
каждый элемент состоит из мельчайших частиц – атомов; -
все атомы одного элемента одинаковы; -
атомы различных элементов обладают разными свойствами; -
атомы одного элемента не превращаются в атомы других элементов результате химической реакции; -
химические соединения образуются в результате комбинации атомов двух и более элементов; -
в данном соединении относительные количества атомов различных элементов всегда постоянны.
2.2) Свой вклад в развитие атомно-молекулярного учения внесли многие учёные, среди них М. В. Ломоносов, Дж. Дальтон, А. Лавуазье, А. Авогадро, Д. И. Менделеев и др.
2.3) Примерами веществ с молекулярной структурой являются вода, различные газы (кислород, азот, углекислый и угарные газы и др.), большинство органических соединений (уксусная кислота, метан и т. д.).
Вещества с немолекулярным строением состоят из атомов или ионов. Примерами таких веществ выступают графит, кремний, алмаз, металлы (к примеру, серебро, марганец, цинк и т. д.), оксиды, гидроксиды и соли (например, хлорид калия, гидрокарбонат натрия и др.).
2.4.1) Решение задачи. В условии задачи сказано, что восстанавливается трехвалентный оксид металла, это можно изобразить в виде следующей схемы:
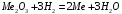
2.4.2) Начнем расчеты с определения количества молей расходуемого газа – водорода, по уравнению:
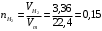 моль
моль2.4.3) Как видно из стехиометрии реакции 1 моль оксида реагирует с 3 моль водорода, следовательно:
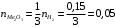 моль
моль2.4.4) Теперь зная количество вещества оксида металла, высчитываем его молекулярную массу:
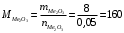 г/моль
г/моль2.4.5) Известно, что молекулярная масса вещества равна сумме атомных масс входящих в него элементов (в соответствии со стехиометрией):
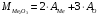
Из этого выражения сможем найти атомную массу металла:
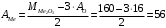 г/моль
г/моль2.4.6) Последний шаг – нахождение эквивалентной массы металла. Эквивалентные массы элементов в соединении находят по формуле:
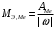 ,
,где
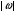 - степень окисления элемента в данном соединении.
- степень окисления элемента в данном соединении.В нашем случае металл в оксиде имеет степень окисления +3, поэтому:
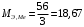 г/моль
г/мольОтвет:
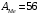 г/моль;
г/моль; 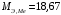 г/моль.
г/моль.Задание 3. Какие соединения называют кислотами? Как кислоты разделяются по их силе? Приведите примеры сильных и слабых кислот. Исходя из положения германия и технеция в периодической системе, составьте формулы их высших кислот. Изобразите их графические формулы. Напишите формулы соответствующих им ангидридов.
Решение: 3.1) Кислоты – химические соединения, состоящие из кислотных остатков и атомов водорода, способных замещаться на атомы металлов с образованием солей.
3.2) Кислоты делят по их силе, иначе говоря, по степени их диссоциации в растворах. Выделяют сильные кислоты, диссоциирующие почти полностью, и слабые кислоты, которые диссоциируют в растворах лишь частично.
3.3) Примерами сильных кислот являются соляная (
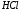 ), серная (
), серная (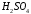 ), азотная (
), азотная (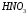 ), хлорная (
), хлорная (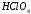 ) и другие. К слабым кислотам относятся угольная (
) и другие. К слабым кислотам относятся угольная (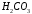 ), сероводородная (
), сероводородная (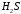 ), сернистая (
), сернистая (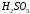 ), азотистая (
), азотистая (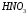 ) и т. д.
) и т. д.3.4.1) Высшие кислоты – это кислородсодержащие кислоты, в которых химический элемент проявляет высшую для него степень окисления, численно равную номеру группы, в которой и находится этот элемент.
Так германий – элемент IV группы Периодической системы, следовательно его высшая СО равна +4. Высшей кислотой германия является ортогерманиевая кислота, графическая формула которой изображена на рисунке 1, а краткая форма записи выглядит следующим образом:
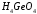 .
. 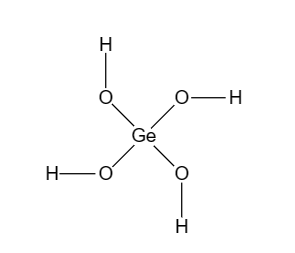
Рис. 1. Графическая формула ортогерманиевой кислоты
3.4.2) Технеций имеет высшую степень окисления +7, так как расположен в VII группе Периодической системы. Высшая для данного элемента кислота – технециевая кислота (
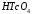 ), её графическую формулу можно увидеть на рисунке ниже.
), её графическую формулу можно увидеть на рисунке ниже.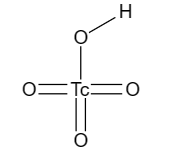
Рис. 2. Графическая формула технециевой кислоты.
3.5) Ангидриды – химические соединения элементов с кислородом, которые получают, отнимая воду у соответствующей кислоты. Для ортогерманиевой кислоты ангидридом является оксид германия (IV) -
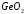 , а технециевой кислоте соответствует оксид технеция (VII) -
, а технециевой кислоте соответствует оксид технеция (VII) - 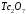 .
.Задание 4: Уравняйте реакции методом электронного баланса, укажите окислитель, восстановитель и тип ОВР. Рассчитайте молярные массы эквивалентов окислителя и восстановителя.