Файл: 1 Вопрос. Основные химические понятия атом, молекула, химический элемент, относительные атомные и молекулярные массы.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 30.10.2023
Просмотров: 279
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
. Процесс происходит только на поверхности адсорбента.

Адсорбция
Адсорбция на границе жидкий раствор – газ
Адсорбция на границе
твердое тело – жидкий раствор
Адсорбция на границе твердое тело – газ
Рис 2.2. Классификация адсорбции в зависимости от агрегатного состояния
адсорбента и адсорбтива.
34 Адсорбция на поверхности раствора. Поверхностно-активные вещества
Измерения поверхностного натяжения растворов показали, что различные растворенные вещества по-разному влияют на поверхностное натяжение растворов.
1. Вещества, понижающие поверхностное натяжение, называются поверхностно-активными (ПАВ). По отношению к водным растворам поверхностно-активными являются спирты, жирные кислоты и их соли, амины и другие вещества, имеющие дифильное строение, т. е. полярную часть (функциональные группы) и неполярную часть (углеводородный радикал). Молекулу ПАВ принято изображать так:

Поверхностно-активные вещества взаимодействуют с водой слабее, чем молекулы воды между собой, значит, попадая на поверхность, они уменьшают поверхностное натяжение.
2. Вещества, повышающие поверхностное натяжение, называются поверхностно-инактивными (ПИВ). К ним относятся сильные электролиты: соли, щелочи, кислоты. Ионы, образующиеся в результате диссоциации, взаимодействуют с водой сильнее, чем молекулы воды между собой. Поэтому значительная часть ионов увлекается молекулами воды в объем раствора. Однако немногие оставшиеся на поверхности ионы создают вблизи поверхности силовое поле, тем самым повышая поверхностное натяжение.
3. Существуют вещества, растворение которых практически не приводит к изменению поверхностного натяжения. Такие вещества являются поверхностно-неактивными. К ним относятся вещества, которые имеют много полярных групп, например, сахароза.
Зависимость поверхностного натяжения от концентрации растворенного вещества σ = f(c) для указанных групп веществ представлена на рис. 3.1.
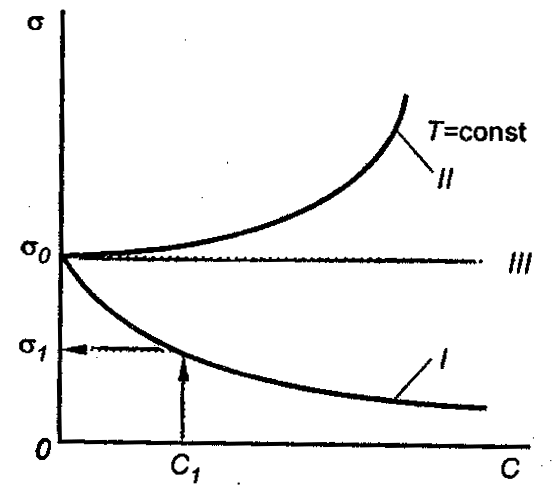
Рис. 3.1. Зависимость поверхностного натяжения от концентрации растворенного вещества.
Из графика видно, что для поверхностно-активных веществ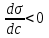 , для поверхностно-инактивных
, для поверхностно-инактивных 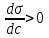 , а для поверхностно-неактивных
, а для поверхностно-неактивных 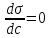
(на графике σ0 – поверхностное натяжение воды). Необходимо обратить внимание на то, что для ПАВ характерно резкое снижение σ даже при малых концентрациях. По мере роста концентрации ПАВ график становится более пологим и, наконец, переходит в горизонтальную прямую, что означает, что поверхностное натяжение достигло своего минимального значения. Увеличение поверхностного натяжения под влиянием ПИВ происходит незначительно, что связано с тем, что концентрация ионов в поверхностном слое незначительна и по составу он близок к чистому растворителю. Необходимо подчеркнуть, что понятия ПАВ и ПИВ не носят абсолютный характер, они определяются выбранным растворителем, его поверхностным натяжением (σ0).
Исходя из второго закона термодинамики, американский ученый Дж. Гиббс в 70-х гг. XIX в. вывел уравнение, связывающее величину адсорбции со способностью растворенного вещества изменять поверхностное натяжение раствора:
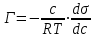 ,
,
где Г – адсорбция; с – молярная концентрация; Т – температура, при которой происходит адсорбция; R – газовая постоянная;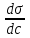 – изменение поверхностного натяжения раствора при изменении концентрации.
– изменение поверхностного натяжения раствора при изменении концентрации.
Если , то Г > 0, т. е. наблюдается положительная адсорбция – вещество концентрируется на поверхности раствора; если
, то Г > 0, т. е. наблюдается положительная адсорбция – вещество концентрируется на поверхности раствора; если  , то
, то
Г < 0, т. е. наблюдается отрицательная адсорбция – вещество уходит с поверхности в объем раствора.
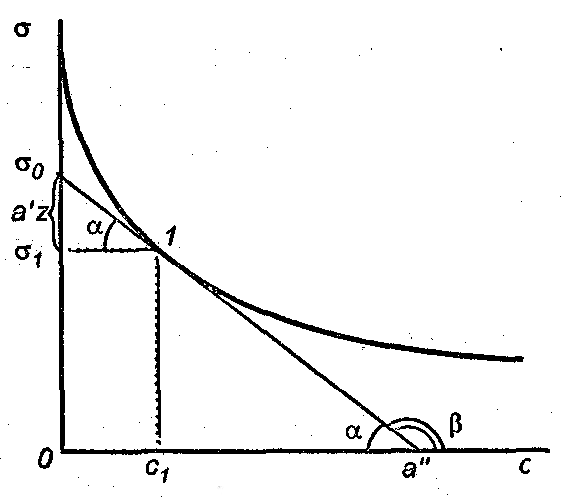
Рис. 3.2. Определение адсорбции
Для того, чтобы рассчитать Г по уравнению адсорбции Гиббса, надо знать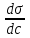 , т. е. производную поверхностного натяжения от концентрации. Из математики известно, что производная – это тангенс угла наклона касательной, проведенной к кривой в данной точке. Следовательно, имея зависимость
, т. е. производную поверхностного натяжения от концентрации. Из математики известно, что производная – это тангенс угла наклона касательной, проведенной к кривой в данной точке. Следовательно, имея зависимость 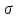 от с (рис. 3.2), можно определить значение
от с (рис. 3.2), можно определить значение 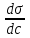
в выбранных точках и построить изотерму адсорбции [Г = f(c)], общий вид которой представлен на рис. 3.3. По мере увеличения концентрации адсорбция возрастает вначале резко, затем все медленнее, асимптотически приближаясь к некоторой величине, называемой предельной адсорбцией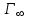 . Существование предельного значения адсорбции понятно, так как поверхность раствора имеет определенную площадь и при достижении определенной кон-
. Существование предельного значения адсорбции понятно, так как поверхность раствора имеет определенную площадь и при достижении определенной кон-
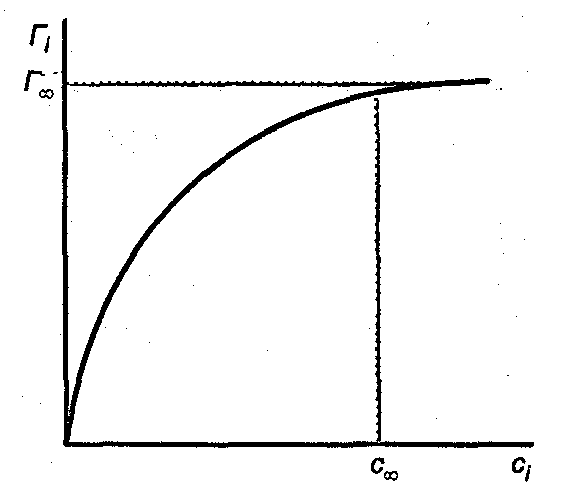
Рис. 3.3. Изотерма адсорбции
центрации ПАВ в растворе (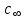 ) она оказывается полностью занятой молекулами ПАВ. Поскольку адсорбция мономолекулярна, дальнейшее увеличение концентрации ПАВ в растворе ничего не может изменить в поверхностном слое. При малых концентрациях углеводородные цепи, вытолкнутые в воздух, «плавают» на поверхности воды, тогда как полярная группа погружена в воду. С ростом концентрации число молекул в поверхностном слое увеличивается, цепи поднимаются. В насыщенном адсорбционном слое поверхность воды оказывается сплошь покрытой «частоколом» из вертикально ориентированных молекул ПАВ.
) она оказывается полностью занятой молекулами ПАВ. Поскольку адсорбция мономолекулярна, дальнейшее увеличение концентрации ПАВ в растворе ничего не может изменить в поверхностном слое. При малых концентрациях углеводородные цепи, вытолкнутые в воздух, «плавают» на поверхности воды, тогда как полярная группа погружена в воду. С ростом концентрации число молекул в поверхностном слое увеличивается, цепи поднимаются. В насыщенном адсорбционном слое поверхность воды оказывается сплошь покрытой «частоколом» из вертикально ориентированных молекул ПАВ.
Из-за вертикальной ориентации молекул ПАВ в поверхностном слое максимальная адсорбция (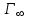 ) не зависит от длины «хвоста» (углеводородного радикала), а определяется только размерами поперечного сечения молекулы, которые в гомологическом ряду остаются неизменными.
) не зависит от длины «хвоста» (углеводородного радикала), а определяется только размерами поперечного сечения молекулы, которые в гомологическом ряду остаются неизменными.
В 1908 г. киевский ученый Б. А. Шишковский эмпирическим путем получил уравнение, связывающее поверхностное натяжение водных растворов ПАВ с их концентрацией:
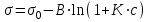 ,
,
где σ0 – поверхностное натяжение воды; σ – поверхностное натяжение раствора; с – концентрация раствора; В – константа, мало зависящая от природы ПАВ внутри данного гомологического ряда; К – удельная капиллярная постоянная.
Зависимость величины адсорбции ПАВ от концентрации выражается уравнением Ленгмюра:
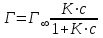 ,
,
где – максимальная адсорбция ПАВ; Г – адсорбция при концентрации с; К – константа адсорбционного равновесия.
– максимальная адсорбция ПАВ; Г – адсорбция при концентрации с; К – константа адсорбционного равновесия.
Объединив уравнения Гиббса и Ленгмюра и осуществив несложные математические операции, получим уравнение, аналогичное уравнению Шишковского:
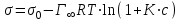 .
.
35 Методы получения коллоидных систем. Строение мицелл.
Коллоидными растворами называются высокодисперсные гетерогенные системы, в которых хотя бы одно вещество находится в коллоидном состоянии.
Коллоидное состояние – это высокодисперсное состояние, когда вещество раздроблено до частиц размерами 10-7 – 10-5 см, невидимых в оптический микроскоп, но представляющих собой агрегаты, состоящие из множества молекул или ионов, такого множества, что этим частицам присущи свойства отдельной термодинамической фазы, называемой дисперсной фазой.
Среда, в которой распределены частицы дисперсной фазы, называется дисперсионной средой.
4.1. МЕТОДЫ ПОЛУЧЕНИЯ ЛИОФОБНЫХ ЗОЛЕЙ
Общие условия получения лиофобных золей – нерастворимость или очень малая растворимость вещества дисперсной фазы в дисперсионной среде и наличие в среде веществ, которые способны стабилизировать частицы дисперсной фазы – стабилизаторов.
По размеру частиц дисперсной фазы лиофобные золи занимают промежуточное положение между истинными растворами и грубодисперсными системами. Следовательно, получить коллоидные растворы можно измельчением крупных частиц до коллоидных размеров (диспергационные методы) и укрупнением молекул и ионов (конденсационные методы).
4.1.1. Диспергационные методы
Диспергационные методы – это способы получения лиофобных золей путем дробления крупных кусков до агрегатов коллоидных размеров.
Существенные черты диспергационных методов:
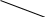

Адсорбция
Адсорбция на границе жидкий раствор – газ
Адсорбция на границе
твердое тело – жидкий раствор
Адсорбция на границе твердое тело – газ
Рис 2.2. Классификация адсорбции в зависимости от агрегатного состояния
адсорбента и адсорбтива.
34 Адсорбция на поверхности раствора. Поверхностно-активные вещества
Измерения поверхностного натяжения растворов показали, что различные растворенные вещества по-разному влияют на поверхностное натяжение растворов.
1. Вещества, понижающие поверхностное натяжение, называются поверхностно-активными (ПАВ). По отношению к водным растворам поверхностно-активными являются спирты, жирные кислоты и их соли, амины и другие вещества, имеющие дифильное строение, т. е. полярную часть (функциональные группы) и неполярную часть (углеводородный радикал). Молекулу ПАВ принято изображать так:

Поверхностно-активные вещества взаимодействуют с водой слабее, чем молекулы воды между собой, значит, попадая на поверхность, они уменьшают поверхностное натяжение.
2. Вещества, повышающие поверхностное натяжение, называются поверхностно-инактивными (ПИВ). К ним относятся сильные электролиты: соли, щелочи, кислоты. Ионы, образующиеся в результате диссоциации, взаимодействуют с водой сильнее, чем молекулы воды между собой. Поэтому значительная часть ионов увлекается молекулами воды в объем раствора. Однако немногие оставшиеся на поверхности ионы создают вблизи поверхности силовое поле, тем самым повышая поверхностное натяжение.
3. Существуют вещества, растворение которых практически не приводит к изменению поверхностного натяжения. Такие вещества являются поверхностно-неактивными. К ним относятся вещества, которые имеют много полярных групп, например, сахароза.
Зависимость поверхностного натяжения от концентрации растворенного вещества σ = f(c) для указанных групп веществ представлена на рис. 3.1.

Рис. 3.1. Зависимость поверхностного натяжения от концентрации растворенного вещества.
Из графика видно, что для поверхностно-активных веществ
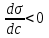 , для поверхностно-инактивных
, для поверхностно-инактивных 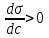 , а для поверхностно-неактивных
, а для поверхностно-неактивных 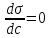
(на графике σ0 – поверхностное натяжение воды). Необходимо обратить внимание на то, что для ПАВ характерно резкое снижение σ даже при малых концентрациях. По мере роста концентрации ПАВ график становится более пологим и, наконец, переходит в горизонтальную прямую, что означает, что поверхностное натяжение достигло своего минимального значения. Увеличение поверхностного натяжения под влиянием ПИВ происходит незначительно, что связано с тем, что концентрация ионов в поверхностном слое незначительна и по составу он близок к чистому растворителю. Необходимо подчеркнуть, что понятия ПАВ и ПИВ не носят абсолютный характер, они определяются выбранным растворителем, его поверхностным натяжением (σ0).
Исходя из второго закона термодинамики, американский ученый Дж. Гиббс в 70-х гг. XIX в. вывел уравнение, связывающее величину адсорбции со способностью растворенного вещества изменять поверхностное натяжение раствора:
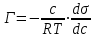 ,
,где Г – адсорбция; с – молярная концентрация; Т – температура, при которой происходит адсорбция; R – газовая постоянная;
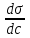 – изменение поверхностного натяжения раствора при изменении концентрации.
– изменение поверхностного натяжения раствора при изменении концентрации.Если
 , то Г > 0, т. е. наблюдается положительная адсорбция – вещество концентрируется на поверхности раствора; если
, то Г > 0, т. е. наблюдается положительная адсорбция – вещество концентрируется на поверхности раствора; если  , то
, то Г < 0, т. е. наблюдается отрицательная адсорбция – вещество уходит с поверхности в объем раствора.

Рис. 3.2. Определение адсорбции
Для того, чтобы рассчитать Г по уравнению адсорбции Гиббса, надо знать
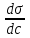 , т. е. производную поверхностного натяжения от концентрации. Из математики известно, что производная – это тангенс угла наклона касательной, проведенной к кривой в данной точке. Следовательно, имея зависимость
, т. е. производную поверхностного натяжения от концентрации. Из математики известно, что производная – это тангенс угла наклона касательной, проведенной к кривой в данной точке. Следовательно, имея зависимость 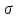 от с (рис. 3.2), можно определить значение
от с (рис. 3.2), можно определить значение 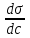
в выбранных точках и построить изотерму адсорбции [Г = f(c)], общий вид которой представлен на рис. 3.3. По мере увеличения концентрации адсорбция возрастает вначале резко, затем все медленнее, асимптотически приближаясь к некоторой величине, называемой предельной адсорбцией
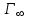 . Существование предельного значения адсорбции понятно, так как поверхность раствора имеет определенную площадь и при достижении определенной кон-
. Существование предельного значения адсорбции понятно, так как поверхность раствора имеет определенную площадь и при достижении определенной кон-
Рис. 3.3. Изотерма адсорбции
центрации ПАВ в растворе (
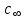 ) она оказывается полностью занятой молекулами ПАВ. Поскольку адсорбция мономолекулярна, дальнейшее увеличение концентрации ПАВ в растворе ничего не может изменить в поверхностном слое. При малых концентрациях углеводородные цепи, вытолкнутые в воздух, «плавают» на поверхности воды, тогда как полярная группа погружена в воду. С ростом концентрации число молекул в поверхностном слое увеличивается, цепи поднимаются. В насыщенном адсорбционном слое поверхность воды оказывается сплошь покрытой «частоколом» из вертикально ориентированных молекул ПАВ.
) она оказывается полностью занятой молекулами ПАВ. Поскольку адсорбция мономолекулярна, дальнейшее увеличение концентрации ПАВ в растворе ничего не может изменить в поверхностном слое. При малых концентрациях углеводородные цепи, вытолкнутые в воздух, «плавают» на поверхности воды, тогда как полярная группа погружена в воду. С ростом концентрации число молекул в поверхностном слое увеличивается, цепи поднимаются. В насыщенном адсорбционном слое поверхность воды оказывается сплошь покрытой «частоколом» из вертикально ориентированных молекул ПАВ.Из-за вертикальной ориентации молекул ПАВ в поверхностном слое максимальная адсорбция (
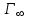 ) не зависит от длины «хвоста» (углеводородного радикала), а определяется только размерами поперечного сечения молекулы, которые в гомологическом ряду остаются неизменными.
) не зависит от длины «хвоста» (углеводородного радикала), а определяется только размерами поперечного сечения молекулы, которые в гомологическом ряду остаются неизменными.В 1908 г. киевский ученый Б. А. Шишковский эмпирическим путем получил уравнение, связывающее поверхностное натяжение водных растворов ПАВ с их концентрацией:
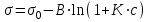 ,
,где σ0 – поверхностное натяжение воды; σ – поверхностное натяжение раствора; с – концентрация раствора; В – константа, мало зависящая от природы ПАВ внутри данного гомологического ряда; К – удельная капиллярная постоянная.
Зависимость величины адсорбции ПАВ от концентрации выражается уравнением Ленгмюра:
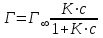 ,
,где
 – максимальная адсорбция ПАВ; Г – адсорбция при концентрации с; К – константа адсорбционного равновесия.
– максимальная адсорбция ПАВ; Г – адсорбция при концентрации с; К – константа адсорбционного равновесия.Объединив уравнения Гиббса и Ленгмюра и осуществив несложные математические операции, получим уравнение, аналогичное уравнению Шишковского:
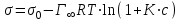 .
.35 Методы получения коллоидных систем. Строение мицелл.
Коллоидными растворами называются высокодисперсные гетерогенные системы, в которых хотя бы одно вещество находится в коллоидном состоянии.
Коллоидное состояние – это высокодисперсное состояние, когда вещество раздроблено до частиц размерами 10-7 – 10-5 см, невидимых в оптический микроскоп, но представляющих собой агрегаты, состоящие из множества молекул или ионов, такого множества, что этим частицам присущи свойства отдельной термодинамической фазы, называемой дисперсной фазой.
Среда, в которой распределены частицы дисперсной фазы, называется дисперсионной средой.
4.1. МЕТОДЫ ПОЛУЧЕНИЯ ЛИОФОБНЫХ ЗОЛЕЙ
Общие условия получения лиофобных золей – нерастворимость или очень малая растворимость вещества дисперсной фазы в дисперсионной среде и наличие в среде веществ, которые способны стабилизировать частицы дисперсной фазы – стабилизаторов.
По размеру частиц дисперсной фазы лиофобные золи занимают промежуточное положение между истинными растворами и грубодисперсными системами. Следовательно, получить коллоидные растворы можно измельчением крупных частиц до коллоидных размеров (диспергационные методы) и укрупнением молекул и ионов (конденсационные методы).
4.1.1. Диспергационные методы
Диспергационные методы – это способы получения лиофобных золей путем дробления крупных кусков до агрегатов коллоидных размеров.
Существенные черты диспергационных методов:
-
Измельчение производится в инертной среде. -
Диспергирование является несамопроизвольным процессом. Образование дополнительной межфазной поверхности связано с накоплением дополнительной свободной поверхностной энергии и происходит за счет совершения внешней работы.