Файл: Расчет адсорбции атома водорода на кристаллическом кластере палладия.docx
Добавлен: 06.11.2023
Просмотров: 62
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
МИНОБРНАУКИ РОССИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ОБРАЗОВАНИЯ
«ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
(ФГБОУ ВО «ВГУ»)
Химический факультет
Кафедра материаловедения и индустрии наносистем
Расчет адсорбции атома водорода на кристаллическом кластере палладия
Бакалаврская работа
Направление 04.03.02 Химия, физика и механика материалов
Профиль Материаловедение и индустрия наносистем
Зав. кафедрой ___________ д.ф.-м. н, проф. В. М. Иевлев __. __.20__г.
подпись
Обучающийся __________ Виви Мардошэ Дьеви Киембе
подпись
Руководитель ___________ д.х.н., доц. В.М. Даринский
подпись
Воронеж 2023
Содержание
Введение
Глава 1. Обзор литературы
-
Взаимодействие в системе водорода-палладия
-
Характеристики адсорбции водорода на поверхности кластера палладия
-
Реакция внедрения водорода в палладий
Глава 2. Расчет энергии и волновые функции атома водорода в объёме и в симметричном кластера палладия с программой gaussian.
Выводы
Список используемой литературы.
Введение.
Известно, что водород — первый элемент в таблице Менделеева и легко проникает во многие материалы, а палладий — переходный металл, обладающий уникальными каталитическими свойствами, особенно в отношении взаимодействия с водородом. Когда палладий находится в форме наночастиц, он может адсорбировать большое количество атомов водорода, что делает его очень привлекательным для промышленных применений, таких как катализ и хранение водорода. Количество водорода, адсорбированного на кластерах палладия, зависит от степени окисления и размера частиц палладия, а также от температуры, давления и чистоты водорода. Расчет количества атомов водорода, которые могут быть адсорбированы на кластерах палладия, позволяет лучше понять свойства этого металла аккумулировать водород и оптимизировать его промышленное применение. В этой задаче мы исследуем взаимосвязь между кластерами водорода и палладия, а также задействованные механизмы адсорбции.
Таким образом, для расчета адсорбции атомов водорода на кластерах палладия используется метод теории функции плотности (DFT). Этот метод позволяет определить электронные свойства поверхности палладия и рассчитать минимальную энергию, необходимую для адсорбции атомов водорода на этой поверхности.
Расчеты DFT выполняются с использованием программного обеспечения для квантово-химического моделирования. Входные параметры включают структуру кластера палладия и положения атомов водорода. Затем компьютерные расчеты определяют распределение электронов и взаимодействия между атомами водорода и палладием. Конечным результатом является набор данных, которые раскрывают электронные свойства поверхности палладия, такие как энергия связи и энергия адсорбции каждого атома водорода на поверхности палладия. Этот результат можно использовать для предсказания количества атомов водорода, которые может поглотить кластер палладия. Таким образом, расчет адсорбции атомов водорода на кластерах палладия включает использование метода DFT для определения электронных свойств поверхности палладия и прогнозирования количества атомов водорода, которые может адсорбировать каждый кластер.
Глава 1. Обзор литературы
-
Взаимодействие в системе водорода-палладия.
Взаимодействие водорода на поверхности переходных металлов очень важно для многих научные приложения. Есть также несколько важных приложений для использования недр. водород. Палладий может быть использован в процессе разделения и очистки водорода. Гидрид палладия также может быть использован для хранения водорода, холодного синтеза и электрохимия. Многие реакции гидрирования, такие как синтез аммиака, страдают от низкой селективность из-за быстрой реакции выделения водорода на многих переходных металлах. В электрохимии можно использовать приложенный потенциал для контроля количества подповерхностного водорода в палладии, но реакционная способность подповерхностного водорода отличается от поверхностного водорода, изменяя баланс между гидрированием и выделением водорода. Поэтому важно исследовать взаимодействие водорода на поверхности переходных металлов, а также в недрах для лучшего понять технологическое и научное использование этих поверхностей [1,2].
После приложения давления водорода он будет включен в палладий. Система водород-палладий имеет две фазы в зависимости от соотношения водород в палладии. Фаза, а представляет собой бедную водородом фазу с Отношение H / Pd <0,025 при 298 K. p-фаза является богатой водородом фазой с отношением H/Pd> 0,7. Параметр решетки на верхнем пределе а-фазы составляет 0,3894 нм, на 0,0007 нм больше, чем для чистого палладия. В фазе P с отношением H/Pd 0,6, параметр решетки 0,4040 нм [3,5]. Границы фаз а и Р равны зависит от температуры, как показано на фазовой диаграмме на рисунке 1.1.1. Характер взаимодействия Pd-H также различается в зависимости от фазы; в фазе, а на считает, что смесь представляет собой твердый раствор, а в р-фазе водород находится в гибридной форме. Критическая точка, выше которой будет только одна фаза, водород-палладий составляет 563 К, 19 бар и отношение H/Pd 0,257. Поглощение водорода приведет к напряжениям в Pd, что вызывает значительные деформации. Сплавы Pd-Ag гораздо меньше подвержены этим деформациям и предпочтительны для процессов очистки водорода [4]. Включение водорода также привести к увеличению удельного сопротивления палладия. Система H/Pd также сверхпроводящий ниже 1,6 К, когда отношение H/Pd больше 0,87 [6] и критическая температура увеличивается с увеличением отношения H/Pd, Tc 10 K экстраполируется для отношения H/Pd, равного 1 [7].
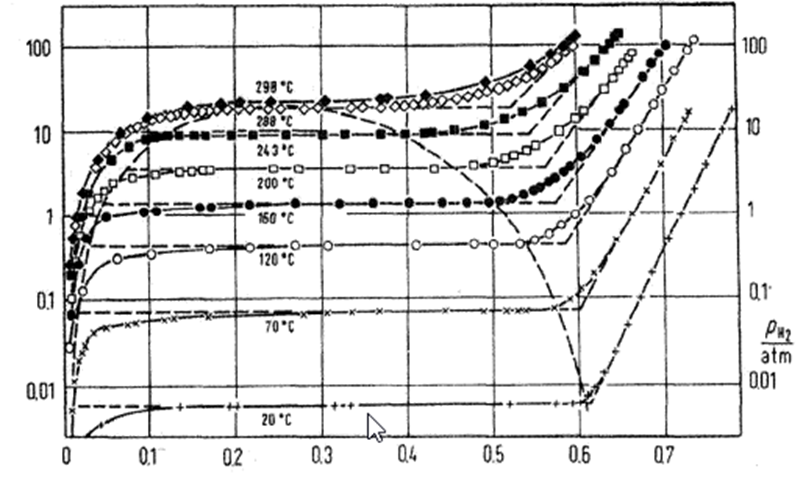
Рис.1.1.1. Фазовая диаграмма давление-состав-температура системы H/Pd.
Знание процессов, связанных с взаимодействием водорода с палладием, весьма важно, в то же время, бороться с явлениями деградации материалов, но также оптимизировать многие производственные процессы, в частности, для производства водород как энергоноситель. Водород может вписаться в кластеры палладия и изменить их свойства [8]. Два параметра, коэффициент диффузии DH и способность внедрения водорода в палладий характеризует взаимодействие водород/палладий.
В таблице 1.1.1 приведены значения этих параметров для некоторых металлов:
Таблица 1.1.1: Значения коэффициента диффузии DH и вносимой способности
водорода в металле [9].
-
Взаимодействие в системе водорода-палладия -
Характеристики адсорбции водорода на поверхности кластера палладия -
Реакция внедрения водорода в палладий
-
Взаимодействие в системе водорода-палладия.
| | Размер ячейки Å | DH cm²/s | Емкость вставки водород (атомное соотношение (Н/Металл)) |
| Железо | 2,86 | 8*10-5 | 0,01 |
| Палладия | 4,025 | 3,5*10-7 | 0,6 |
| платина | 3,92 | 7*10-7 | 0,12*10-4 |
Из таблицы 1.1.1 видно, что вносимая емкость и коэффициент диффузии водорода значительно различаются от металла к металлу, поэтому часто считается, что водород легко диффундирует в металлы из-за его небольшого размера. Емкость скорость внедрения водорода в палладий (H/Pd) = 0,6, в то время как проникновение водород в платине незначителен.
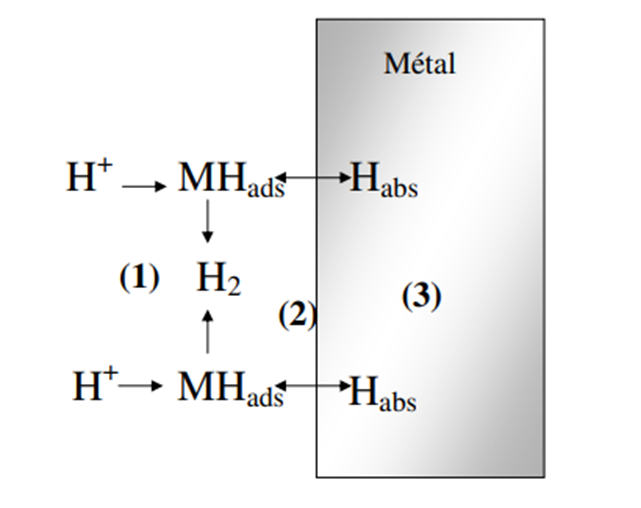
Рисунок 1.1.2. Общая схема взаимодействия водорода с металлом, где мы находим при как поверхностные реакции, так и, возможно, процесс проникновения водорода в металле.
Процессы с участием водорода на металле и в металле распадаются на несколько стадий. Поверхностные реакции делятся на:
- снижение Н+ или H2O в атомарный H.
- адсорбция на поверхности катода (1): образование адсорбированного водорода,
- выделение молекулярного водорода химическим или электрохимическим путем,
- реакция проникновения (2): существует равновесие между адсорбированным водородом и водородом поглощается на границе раздела металлов. Объемные процессы (внутри металла (3)) в основном связаны с диффузией поглощенный через мембрану водород, всегда осложненный проблемами, ловушка. Если выходная поверхность мембраны открыта (прохождение водорода через мембрану металлический), мы будем в пропускающих условиях: то есть водород может выйти из мембраны. Если поверхность выхода закрыта (заблокирована водонепроницаемой подложкой водород (в случае золота) или если это массивный электрод), мы будем в условиях отражающий: т. е. водород не может выйти из электрода. Это краткое напоминание о взаимодействии водорода и металла показывает интерес к характеристике электрохимия последних. Также для лучшего понимания механизмов взаимодействия водорода со структурой металла, изучение адсорбции и поглощения водорода необходимо для палладия, имеющего функции способны поглощать значительное количество водорода.
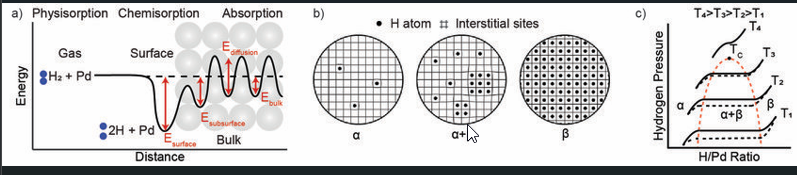
Рис.1.1.3. Взаимодействие палладия с водородом.
. (а) Энергетический ландшафт, с которым сталкивается молекула водорода H2 при взаимодействии с поверхностью Pd. На первом этапе молекула H2 диссоциирует на поверхности Pd. На следующем этапе образовавшиеся атомы водорода H диффундируют в подземную область и занимают подземные межстраничные сетевые сайты. Впоследствии H диффундирует в междоузлия дальше в массу.
(б) Схема различных стадий гидрида палладия. В режиме низкого давления водорода H сильно разбавлен в твердом растворе (α-фаза), локально расширяя решетку-хозяин Pd. Увеличить равновесная концентрация Н в сети, как следствие повышения давления водорода в окружающей среде, в итоге создает значительное притяжение HH-взаимодействия через поля деформации и электронные взаимодействия, которые способствуют образованию зародышей гидрида (β-фаза). Затем рост β-фазы продолжается до тех пор, пока не будет трансформирован весь хост Pd, и это сопровождается значительным расширением сети.
(c) Диаграмма состава давления изотермы системы Pd-водород и соответствующая фазовая диаграмма. Равновесное давление плато, при котором сосуществуют α- и β-фазы, равно зависит от температуры и отличается образованием и разложением гидрида из-за гистерезиса. Ширина верха и ширина гистерезис уменьшается при более высоких температурах, пока они в конце концов не исчезнут при критической температуре TC.
Pd позволяет практически безбарьерная диссоциация молекулы водорода (H2). в хемосорбированных атомах водорода (H) на его поверхности при комнатной температуре условиях (рис. 1.1.3). Когда эти атомы образуются, они быстро насыщают поверхность и диффундируют в междоузлия сетевые сайты в подземном регионе и, наконец, в большинстве система у вас под рукой. Во время диффузии атомы H сталкиваются с энергией ландшафт (рис. 1.1.3), для которого характерны подземные площадки более благоприятны по сравнению с массовыми интерстициалами. следовательно, подземные участки можно считать занятыми, независимо от концентрации водорода в объеме. Для этого конец, расширение этого подземного водородного слоя было предлагается от 0,3 до 1 нм. [10-13] Показано, что присутствие водорода в недрах слой приводит к возникновению деформации решетки, которая может влиять термодинамика процесса сорбции на нано уровне системы, такие как наночастицы. Поскольку поверхность является первым и последним контактом водородной молекулы при взаимодействии с Pd играет ключевую роль в процесс поглощения. Поэтому любая модификация физики и химические свойства поверхности, такие как примеси и сильно адсорбированные молекулы или перегруппировка атомов из-за, например, повторная облицовка или поверхностная сегрегация элементов в сплаве, в некоторой степени влияют на сорбционные процессы, изменяя глобальный энергетический ландшафт. [22,14-21], кроме того, отношение поверхности к объему (SVR) наноструктур обеспечивает путь к изменению кинетики сорбции, где более мелкие структуры.
-
Характеристики адсорбции водорода на поверхности кластера палладия.
Адсорбция — самопроизвольный процесс увеличения концентрации растворённого вещества у поверхности раздела двух фаз (твёрдая фаза — жидкость, конденсированная фаза — газ) вследствие нескомпенсированности сил межмолекулярного взаимодействия на разделе фаз [23].
Хранение H2 в твердой фазе стало возможным благодаря двум явлениям между газы и твердые вещества. Дополнительным образом интересующая нас адсорбция определяется взаимодействием между газ и поверхность твердого тела и, следовательно, фиксация водорода на поверхности материала исключительно. Диссоциация молекулярного водорода на поверхности палладия эффективно приводит к растворению атомов в объеме и, возможно, представляет собой наиболее важный прототип для фундаментальных исследований внедрения водорода в металлы [24-26]. Адсорбция водорода на поверхности палладия происходит при низких температурах и высоких давлениях. Некоторые характеристики этого процесса включают: Физический процесс, Кинетика реакции, Количество поглощенного водорода, Селективность, Регенерация, Приложения.
Есть также две формы водорода, адсорбированного на поверхности палладий в водной среде: субнернстовский водород (недостаточно осажденный) и супернернстовский водород. Оба типы водорода расположены в разных местах на поверхности. H- недостаточно осажденный связан больше сильно палладию и расположен в высоко- и три координированных сайтах. H- избыточно депонированный, расположены на атомах палладия (так называемые верхние узлы) и отвечают за производство водород [27]. было показано, что большие энергии связи легирующего элемента с матрицей палладия препятствуют сорбции водорода [28–32]. Отталкивающее взаимодействие между водородом и переходными металлами, расположенными слева от палладия, было объяснено на основе правила” обратной стабильности“ Мидемы, а в случае примесей благородных металлов — размерным эффектом [32]. Металлический палладий абсорбирует водород как из газовой фазы, так и из растворов при электрохимической поляризации c образованием нестехиометрических гидридов палладия (PdHx) [33].
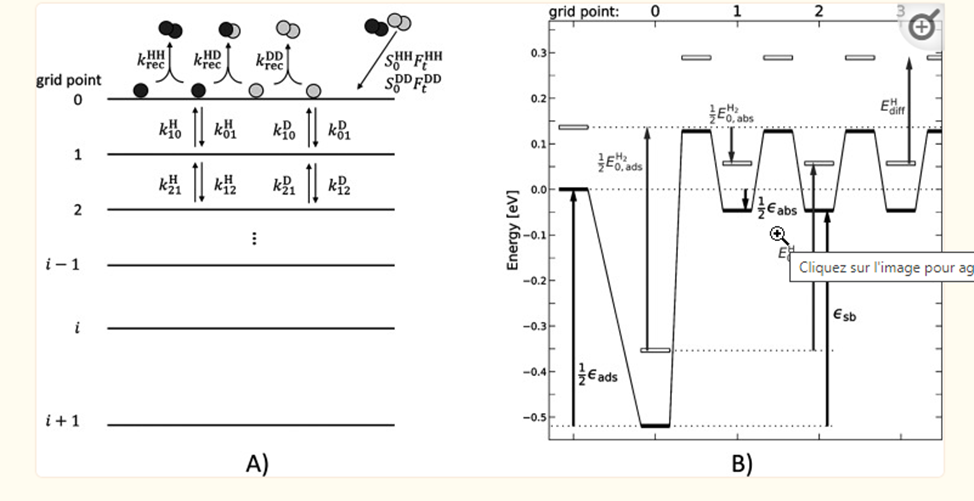
Рисунок 1.2.1.
-
Схематическая диаграмма, показывающая кинетические процессы диссоциативной адсорбции молекулярного водорода и диффузии к массе образующихся атомов. (B) Блок-схема координаты реакции. Сплошные черные линии обозначают классическую энергетическую диаграмму. Энергии с поправкой на энергию нулевой точки также показаны для H. Также показаны соответствующие энергии, представленные в тексте. Энергетическая шкала по оси Y относится к одному атому.
В палладии и его сплавах с гранецентрированной кубической структурой, это было показано с помощью дифракции нейтронов и DFT (функциональная плотность Теория», Теория функционала плотности), что водород 36 в октаэдрических узлах кристаллической решетки [34-35]. Затем водород может свободно диффундировать в кристаллической решетке скачками с октаэдрической позиции на октаэдрическую. Присутствие H в палладии оказывает большое влияние на его физико-химические свойства. Во-первых, при комнатной температуре и с низким содержанием водорода (<2%), вводится в виде твердого раствора, называемого α-фазой. Однако при более высокой концентрации водорода в палладии, гидридная фаза, называемая β, образуется, когда концентрация в водороде больше 60% [36-37].
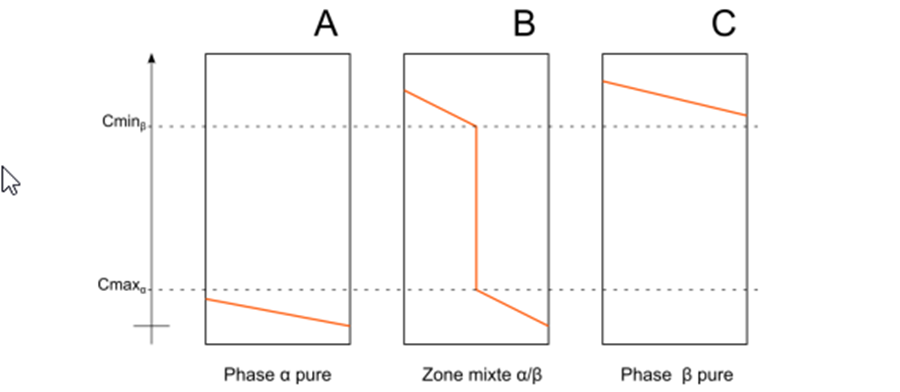
Рисунок 1.2.2. Схема различных случаев диффузии водорода через палладиевую мембрану в Трансмиссивные условия [38].
-
Реакция внедрения водорода в палладий.
Гидрогенизация — это химическая реакция, заключающаяся в присоединении молекулы ди водорода (H2) к другому соединению. Эта реакция обычно используется для восстановления или насыщения органических соединений [39]. Гидрирование палладия интенсивно изучалось, чтобы выяснить кинетику диффузионно-индуцированные фазовые переходы, которые являются представительным классом атомов и диффузии ионов в твердых телах и тесно связана с физикой лидирования аккумуляторы [40,41]. Быстрая кинетика реакции палладия с водородом в сочетании с доступными условиями окружающей среды делает палладий отличным материалом для быстрого поглощения большого количества водорода. Например, палладиевые мембраны вызвали большой интерес из-за их способности отделять и очищать водород при высоком потоке и исключительной селективности. В этих молекулярных системах газовых сепараторов на основе палладиевой мембраны водород сначала диссоциирует на поверхности палладиевой мембраны с последующей диффузией через мембрану, а затем появляется в виде молекулярного водорода при связывании атомов. Поглощение и десорбция водорода в палладии сопровождаются значительным изменением объема, и отслеживание эволюции деформации, связанной с металлической решеткой, во время гидрирования в реальном времени потенциально может дать