ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 07.11.2023
Просмотров: 88
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Проведение опытов
С
1
8
7
2
4
3
6
5
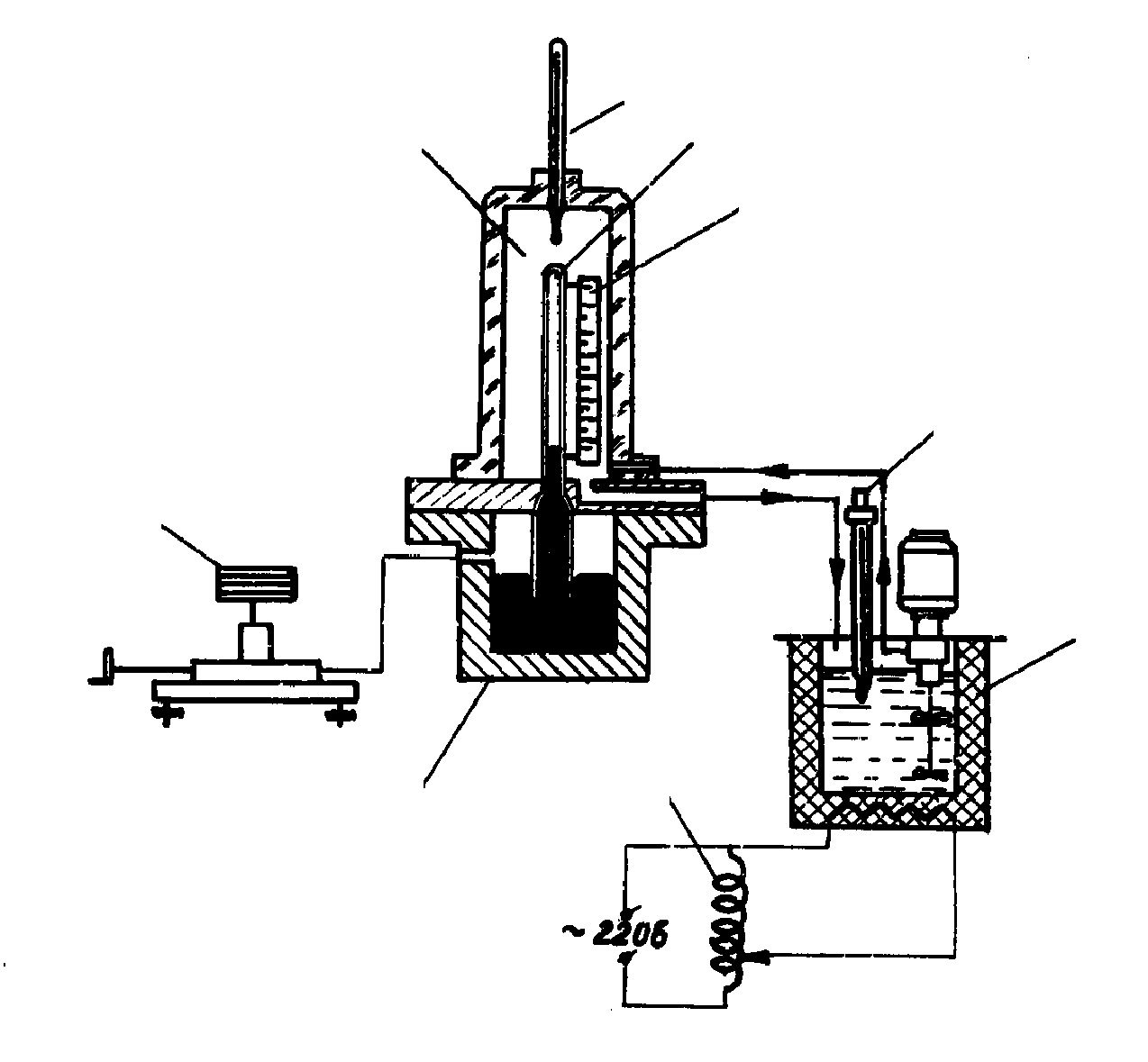
Рис.3. Схема экспериментальной установки.
1 – стеклянный капилляр, заполненный СО2; 2 – ячейка из оргстекла; 3 – стальной сосуд со ртутью; 4 – масляный пресс; 5 – термостат; 6 – контактный термометр; 7 – мерная линейка; 8 – термометр.
хема экспериментальной установки представлена на рис. 3. Углекислый газ (СО2) находится в толстостенном капилляре 1, выдерживающем давление 710 МПа. Давление создается масляным прессом 4 и через ртуть передается сжимаемому газу. Постоянство заданной температуры обеспечивается термостатом, подающим воду в прозрачную ячейку 2 из оргстекла, где помещается капилляр 1.
Изменение объема газа при сжатии и происходящая при этом конденсация четко фиксируется по положению границы ртути в капилляре с помощью шкалы на мерной линейке 7.
Температура в ячейке измеряется ртутным термометром 8, избыточное давление сжимаемого газа – образцовым манометром.
Работа выполняется в следующей последовательности:
Перед проведением опытов измерить и записать атмосферное давление В и цену деления шкалы манометра.
-
Включить термостат с мешалкой. Установить на термостате заданную температуру опыта t1 и дождаться ее установления в измерительной ячейке. Значение этой температуры занести в таблицу 2. -
Вращая маховик масляного пресса, сжать газ настолько, чтобы в поле зрения капилляра появился мениск ртути. Занести в таблицу 2 показания манометра ризб. (в делениях) и по шкале мерной линейки высоту газа в капилляре l, мм, пропорциональную сжимаемому объему СО2. -
Повышать давление (по 2 деления шкалы манометра) до появления мениска конденсата над ртутным столбиком (точка 2 на рис. 2). Данные занести в таблицу измерений 2, где отметить точку 2. -
Сжать газ до давления, соответствующего 50 делениям манометра и перевести вещество в жидкое состояние. Занести в таблицу высоту жидкости lотметить в таблице эту точку (точка 4 на рис. 2).
Таблица 2
| №№ опытных точек | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | ||
| t1 = , С | ризб. | делений | | | | | | | | | | | | | | | |
| кгс/см2 | | | | | | | | | | | | | | | | ||
| рабс. | МПа | | | | | | | | | | | | | | | | |
| l | мм | | | | | | | | | | | | | | | | |
| v | м3/кг | | | | | | | | | | | | | | | | |
| В = , мм рт. ст. | Шкала манометра 1 дел = , кгс/см2 | ||||||||||||||||
-
Вращением маховика пресса понижать давление по 2 деления за опыт, записывая высоту жидкости в капилляре. После появления в капилляре газа над жидкостью опыты прекратить. -
По указанию преподавателя повторить действия п.п. 1-4 при температуре t2. -
Показать результаты измерений преподавателю.
Положение точки 3 на pv-диаграмме (рис. 2) определяется графическим построением. Она находится на пересечении горизонтальной прямой через точку 2 и вертикальной прямой, проходящей через точку 4.
Обработка опытных данных
-
Рассчитать абсолютное давление газа для всех измерений:
1 кгс/см2 = 735,6 мм рт. ст.;
750 мм рт. ст = 105 Па = 0,1 МПа.
При определении ризб. необходимо учитывать цену деления манометра. Результаты занести в таблицу 2.
-
Удельный объем, равный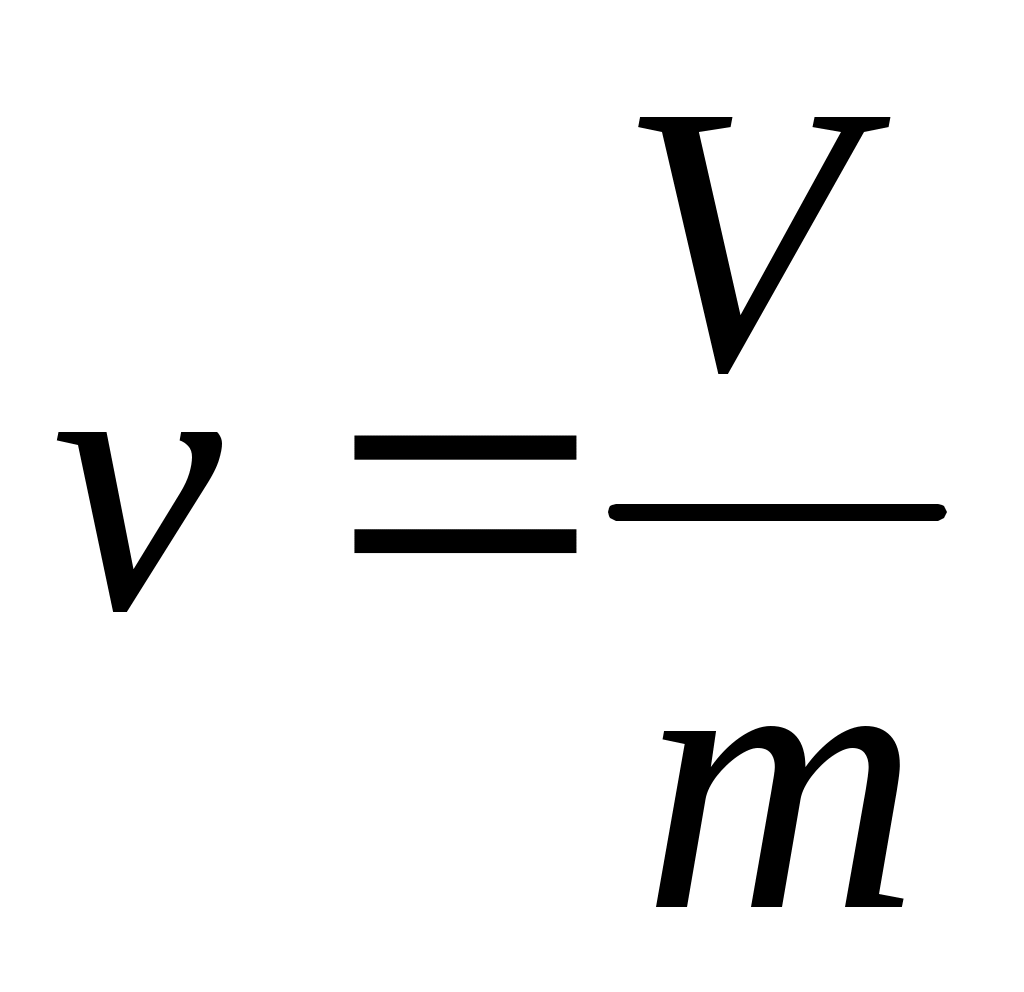 , (м3/кг), из опыта рассчитывается как:
, (м3/кг), из опыта рассчитывается как: 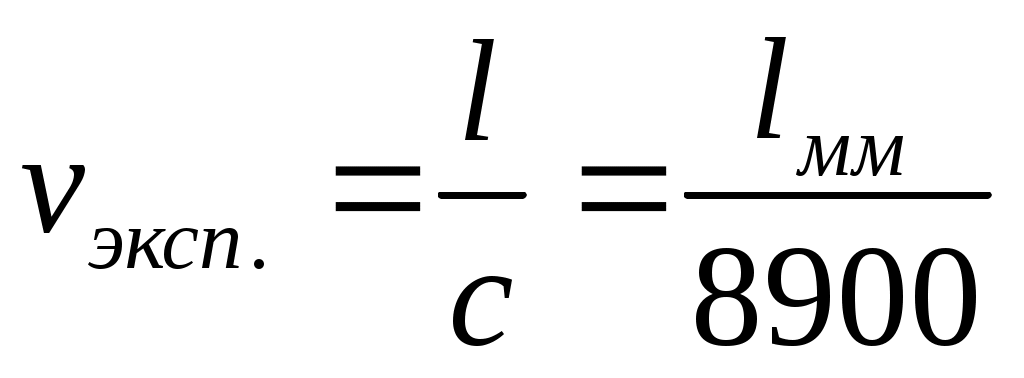 , м3/кг,
, м3/кг,
где V – объем СО2 в капилляре, м3;
m масса СО2 в капилляре, кг;
l высота газа в капилляре, мм;
с постоянная капилляра, с = 8900.
-
На миллиметровой бумаге построить pv-диаграмму по опытным данным, выбрав масштабы по осям
Используя известные параметры в критической точке К для СО2 (из таблицы 1), нанести предполагаемые пограничные кривые АК и БК. Показать на диаграмме области: жидкого, влажного насыщенного и перегретого состояния вещества, обозначить кривые кипящей жидкости и сухого насыщенного пара.
Показать пунктирными линиями предполагаемую критическую изотерму.
-
Из уравнения (4) рассчитать коэффициент неидеальности z для состояния, указанного преподавателем. Для этой же точки определить коэффициент неидеальности z по - диаграмме.
- диаграмме. -
Рассчитать систематическую погрешность измерений в заданной точке: давления р, барометрического давления В и температурыt:
где
Подробно материал к этому пункту изложен в разделе «Оценка погрешности эксперимента».
Контрольные вопросы
-
Понятие об идеальном и реальном газах. -
Уравнение Клапейрона-Менделеева, Ван-дер-Ваальса и приведенное уравнение состояния реальных газов. -
Коэффициент сжимаемости. -диаграмма.
-диаграмма. -
Вириальное уравнение состояния. Вириальные коэффициенты. Определение второго и последующих вириальных коэффициентов. -
Опыт Эндрюса. pv-диаграмма реальных газов. Характер изотерм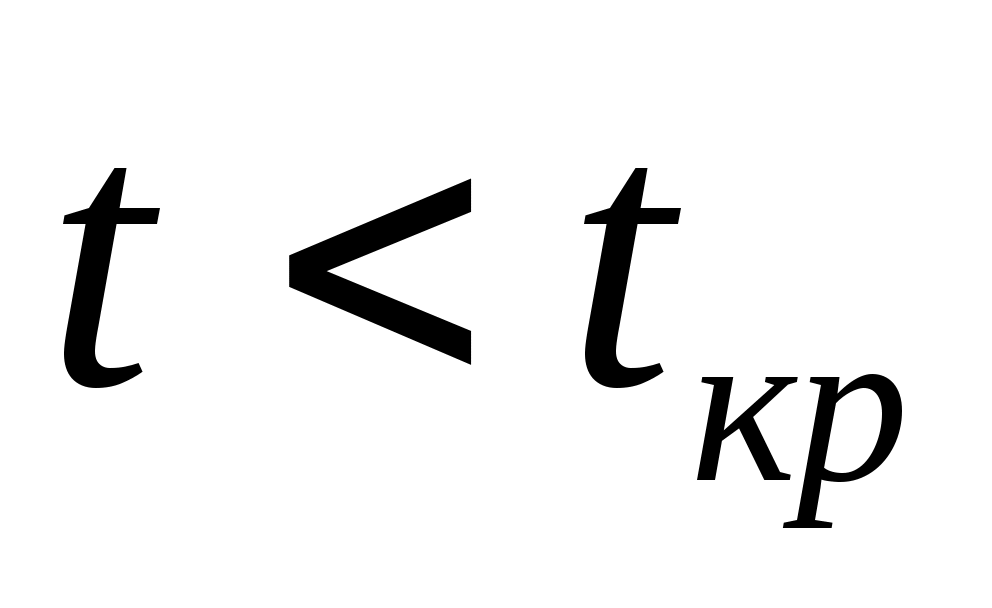 ,
, 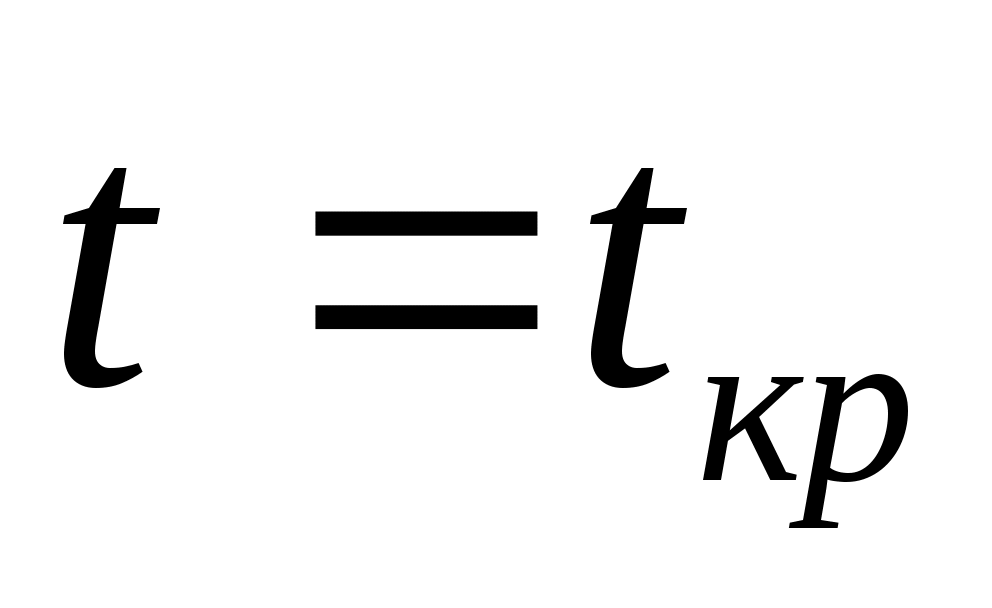 и
и  .
. -
Области фазовых состояний вещества. Понятие о степени сухости. Характер изменения давления р и температуры t в области фазовых переходов газ жидкость. -
Критическая точка, критическое состояние вещества. -
Особенности критической и околокритической области состояний вещества. Перспективы применения особых свойств этого состояния в промышленности. -
Экспериментальная установка и результаты опытов. -
Источники погрешностей измерения. Виды погрешностей. Методика расчета.
Лабораторная работа № 24
Исследование кривой насыщения влажного пара
Цель работы: изучить pv- и Ts-диаграммы водяного пара, изучить процессы фазового перехода; ознакомиться с понятием теплоты парообразования и ее свойствами; ознакомиться с кривой насыщения и уравнением Клапейрона-Клаузиуса.
Задание:
-
Провести опыты по исследованию кривой насыщения воды и водяного пара, т.е. зависимость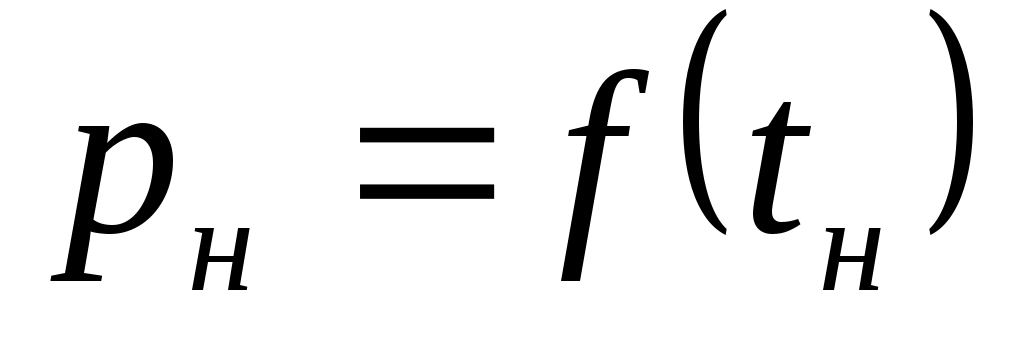 .
. -
На основе результатов измерений рассчитать величину теплоты парообразования r, ее составляющих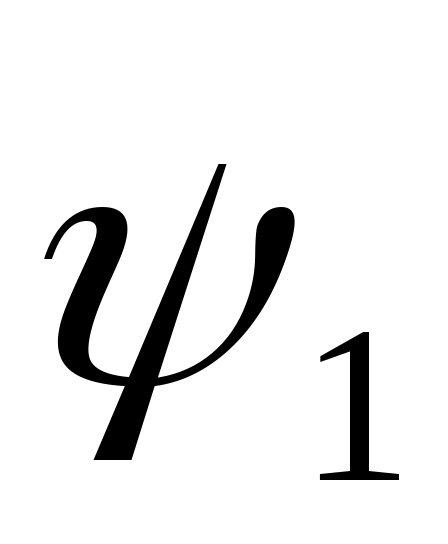 и
и 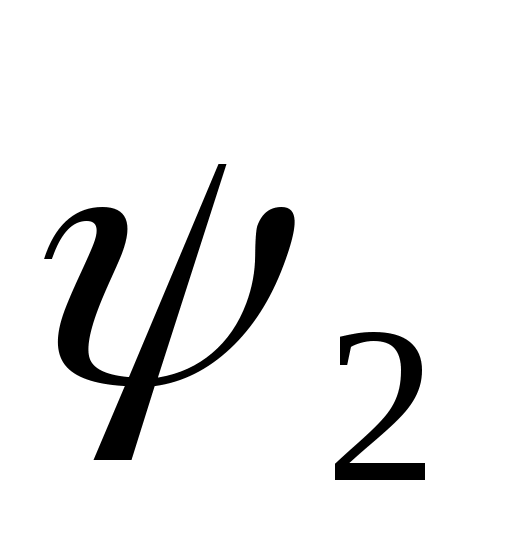 , энтальпии hx, внутренней энергии их, энтропии sx при заданной преподавателем температуре
, энтальпии hx, внутренней энергии их, энтропии sx при заданной преподавателем температуре  .
. -
Составить отчет о выполненной работе, который должен содержать: основы теории (кратко), схему экспериментальной установки, таблицу измерений и результаты обработки опытных данных, а также график, выполненный на миллиметровой бумаге.
Основы теории
Процессы парообразования и конденсации широко распространены в химической технологии. Важной теплофизической характеристикой при расчете процессов перегонки, выпарки, ректификации, кипения и сушки является теплота парообразования r.
Для исследования термодинамических процессов, происходящих с реальными газами, большое значение имеют pv- и Ts-диаграммы (рис. 1 и 2).
Кривые a1b1c1d1, a2b2c2d2… на pv-диаграмме соответствуют процессу расширения вещества при t = const, а кривые ab1c1f1, ab2c2d2… на Ts-диаграмме – процессу нагревания вещества при p = const.
v’ vx=vкр v”
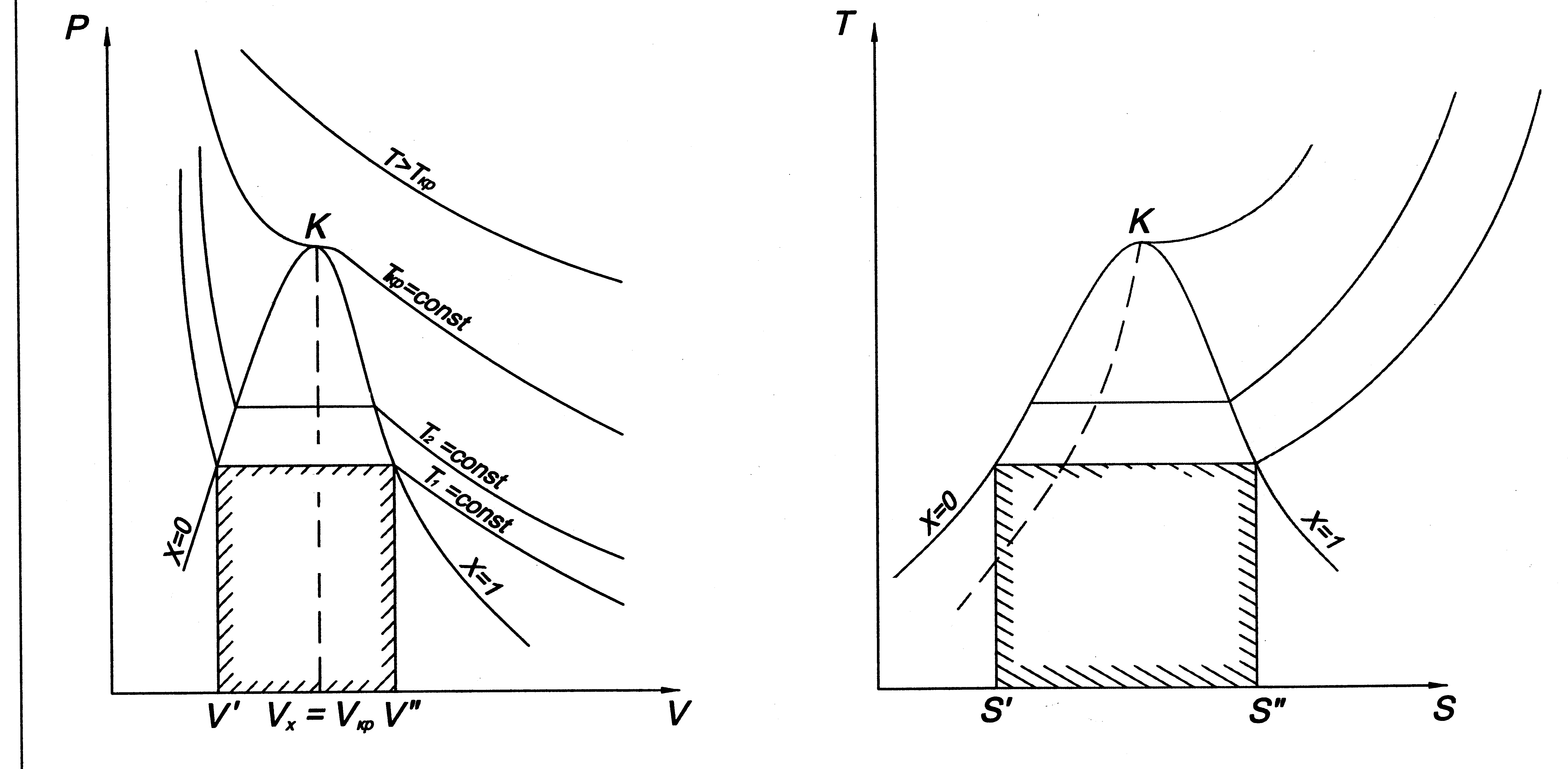
Рис.1. pv– диаграмма водяного Рис.2. Ts– диаграмма
пара. водяного пара.
Ψ1= pн(v”- v’)
r= Tн(s”- s’)
s’ s” s
d2
d1
f1
a2
a1
b1
b2
b1
b2
c1
c2
f2
pн=const
Tн=const
pн=const
Tн=const
a
a2
f2
pн=сonst
Tн=сonst
pн=сonst
Tн=сonst
b1
b2
a1
c1
c2
b1
b2
c2
c1
На обеих диаграммах точки b1, b2,… соответствуют началу процесса парообразования и образуют нижнюю пограничную кривую – кривую кипящей жидкости (х = 0). На этих же диаграммах в точках