ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.08.2021
Просмотров: 411
Скачиваний: 2
Пример Диизопропилфторфосфат ингибирует ферменты, имеющие серин в активном центре. Таким ферментом является ацетилхолинэстераза, катализирующая следующую реакцию:
Реакция происходит каждый раз после проведения нервного импульса, прежде чем второй импульс будет передан через синапс. Диизопропилфторфосфат - одно из отравляющих веществ нервно-паралитического действия, так как приводит к утрате способности нейронов проводить нервные импульсы.
Пример. Терапевтическое действие аспирина как жаропонижающего и противовоспалительного средства объясняется тем, что аспирин ингибирует один из ферментов, катализирующий синтез простагландинов (ПГ). Простагландины - вещества, участвующие в развитии воспаления. Ингибирование обусловлено ковалентной модификацией одной из аминогрупп фермента - простагландинсинтетазы.
3. РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ
Способность к регуляции делает ферменты важными участниками и своеобразными организаторами клеточных процессов в организме человека. Регуляция скорости ферментативных реакций в клетке — основной механизм не только контроля и координации метаболических путей, но и роста и развития клетки, а также ее ответа на изменение окружающей среды.
Существует два основных способа контроля скорости ферментативных реакций:
— Контроль количества фермента.
Количество фермента в клетке определяется соотношением скоростей его синтеза и распада. Этот способ регуляция скорости ферментативной реакции является более медленным процессом (проявляется спустя несколько часов), чем регуляция активности фермента (практически мгновенный ответ).
— Контроль активности фермента.
Активность фермента может регулироваться путем взаимодействия с определенными веществами, изменяющими конформацию активного центра.
Некоторые способы регуляции активности ферментов представлены на рисунке 10.
Регуляция субстратом реакции
Регуляция ферментативной активности, осуществляемая в центре присоединения субстрата, носит название изостерической.
Одним из относительно простых способов регуляции активности ферментов является регуляция с помощью изменения концентрации субстратов реакции. Чем больше в распоряжении фермента имеется молекул веществ, превращения которых он осуществляет, тем выше (до определенных пределов) скорость процесса. При насыщении всех молекул фермента субстратом скорость реакции достигает максимального уровня. В дальнейшем скорость реакции может понизиться по мере исчерпания запасов субстрата и вновь возрасти при их восстановлении.
Слишком большая концентрация субстрата также может понижать скорость ферментативной реакции. Этот феномен носит название субстратного торможения.
В качестве примера субстратного торможения можно привести фермент, расщепляющий биологически активное вещество ацетилхолин - ацетилхолинэстеразу (АХЭ). К активному центру АХЭ субстрат (ацетилхолин) присоединяется двумя концами молекулы одновременно. При увеличении концентрации ацетилхолина с одной молекулой фермента могут одновременно реагировать две молекулы субстрата, но разными концами. В этом случае реакция, суть которой заключается в разрыве сложноэфирной связи в середине молекулы ацетилхолина (с образованием холина и уксусной кислоты), оказывается невозможной, и молекулы ацетилхолинэстеразы, нагруженные субстратом, оказываются тем не менее лишенными активности.
Уменьшение концентрации ацетилхолина в среде приведет к диссоциации неактивного комплекса и снимет торможение. Этот механизм имеет важное физиологическое значение для регуляции концентрации ацетилхолина, который выполняет в нервной системе и мышцах роль медиатора, передающего возбуждение с одной клетки на другую.
Аллостерическая регуляция. Фермент изменяет активность с помощью нековалентно связанного с ним эффектора. Связывание происходит в участке, пространственно удаленном от активного (каталитического) центра (allos - иной). Это связывание вызывает конформационные изменения в молекуле белка, приводящие к изменению определенной геометрии каталитического центра. Активность может увеличиться - это активация фермента, или уменьшиться - это ингибирование.
«Сообщение» о присоединении аллостерического активатора передается посредством конформационных изменений каталитической субъединице, которая становится комплементарной субстрату, и фермент «включается». При удалении активатора фермент вновь переходит в неактивную форму и «выключается». Аллостерическая регуляция является основным способом регуляции метаболических путей.
Метаболические цепи
Обычно ферментативные реакции в клетке организованы в метаболические цепи или циклы, где самая медленная стадия лимитирует скорость всей цепи, то есть последовательности реакций, объединяемых общими субстратами (рис.9).
В таких цепях нередко наблюдается так называемая регуляция по типу обратной связи. Она служит для того, чтобы скорректировать работу цепи с потребностями клетки в конечном продукте. Принцип регуляции заключается в том, что ферменты, стоящие в начале цепи, ингибируются отдаленными метаболитами или конечными продуктами.
Такая регуляция чаще всего происходит по аллостерическому типу, когда молекула регулятора связывается с ферментом в специальном регуляторном центре. Аллостерические ферменты часто выполняют ключевую роль в регуляции обмена веществ, поскольку обладают способностью определять количество важных метаболитов и изменять в соответствии с этим свою активность.
В каждой метаболической цепи есть фермент, который задает скорость всей цепочке реакций. Он называется регуляторным ферментом.
Ферменты, регулирующие скорость метаболических путей:
- обычно действуют на ранних стадиях метаболических путей, в местах ключевых разветвлений метаболических путей;
- катализируют в условиях клетки практически необратимые реакции, протекающие наиболее медленно (ключевые).
|
Метаболическая цепь: А, В, С, D - метаболиты, Е1, Е2, Е3, Е4 - ферменты |
Химическая модификация молекул ферментов (рис.10)
Химическая модификация белков осуществляется за счет присоединения к аминокислотным остаткам в молекуле белка определенных групп: фосфатной группы (при участии протеинкиназ), остатка жирной кислоты (с помощью ацилтрансфераз), углеводных компонентов (гликозил-трансферазы, гликозидазы).
Белки, как правило, имеют лабильную структуру, упаковка которой сильно зависит от свойств химических групп, входящих в состав молекулы. Поэтому присоединение к молекуле белка дополнительных группировок существенно влияет на структуру, а следовательно, и на ферментативную активность молекулы. Такая регуляция носит приспособительный (адаптационный) характер.
Пример. Регуляция активности ферментов путем фосфорилирования-дефосфорилирования. Фермент изменяет активность в результате ковалентной модификации. `
В этом случае фосфатная группа - ОРО32- присоединяется к гидроксильным группам в остатках серина, треонина или тирозина. В зависимости от природы фермента фосфорилирование может его активировать или, наоборот, инактивировать. Реакция присоединения фосфатной группы и ее отщепление катализируют специальные ферменты - протеинкиназы и протеинфосфатазы.
Фосфорилирование - распространенный способ изменить свойства некоторых клеточных белков. Так, при фосфорилировании компонентов цитоскелета (комплекса структурных белков, обеспечивающих поддержание прочности и функционирования клетки) изменяются прочность его взаимодействия с мембраной и форма клеток. Фосфорилирование белков - регуляторов сокращения активирует сократительную реакцию мышцы.
Регуляция с помощью химической модификации белка приводит к долговременным последствиям: модифицированные молекулы сохраняют свои функции измененными до тех пор, пока специальные ферменты не отщепят модифицирующую белок химическую группу и не вернут его в исходное состояние.
Регуляция путем белок-белковых взаимодействий (ассоциации-диссоциации субъединиц в олигомерном ферменте). (рис.10) Например, фермент протеинкиназа в неактивной форме построена как тетрамер R2C2 (R и С - разные субъединицы). Активная протеинкиназа представляет собой субъединицу С, для освобождения которой необходима диссоциация комплекса. Активация фермента происходит при участии цAMP, который способен присоединиться к субъединице R, после чего изменяется конформация, комплементарность субъединиц R и С и происходит диссоциация комплекса: R2C2 + 2cАМР 2С + 2(R -цАМР)
Протеинкиназа фосфорилирует соответствующие ферменты, изменяет их активность и, следовательно, скорость метаболизма в клетке.
Активация ферментов путем частичного протеолиза
Чачтичный протеолиз-разрушение белковой структкры до аминокислотных остатков,для того.чтобы слизистая пожелудочной не разрушилась от трипсина
. Некоторые ферменты синтезируются первоначально неактивными и лишь после секреции из клетки переходят в активную форму. Неактивный предшественник называется проферментом. Активация профермента включает модификацию первичной структуры с одновременным изменением конформации. Например, трипсиноген, синтезированный в поджелудочной железе, затем в кишечнике превращается в трипсин путем удаления фрагмента с N-конца гексапептида. Расщепление определенных пептидных связей «запускает» новые взаимодействия R-групп по всей молекуле, приводя к новой конформации, в которой R-группы активного центра занимают оптимальное положение для катализа (рис.10).
Роль липидного окружения.
Изменение вязкости микроокружения белковых молекул управляет взаимодействием между белками в олигомерных комплексах и регулирует активность мембраносвязанных ферментов.. Этот тип регуляции, который обнаружен в случае многих мембранных белков, обеспечивает тонкую настройку их работы на сиюминутные потребности клетки.
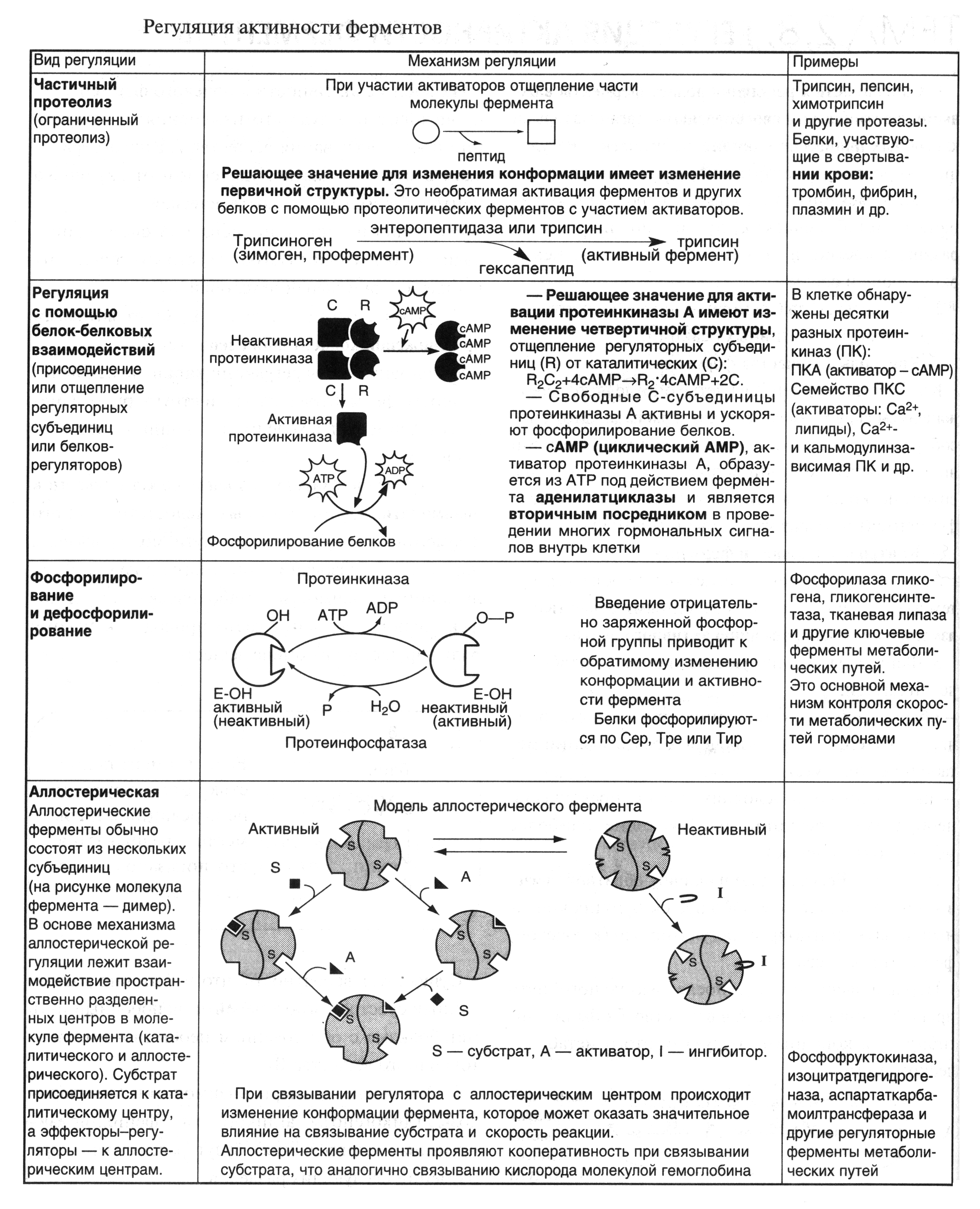
Рис.10
Номенклатура и классификация ферментов
Ферментология очень долго не располагала строго научной номенклатурой ферментов. Наименования ферментам давали по случайным признакам (тривиальная номенклатура), по названию субстрата (рациональная), по химическому составу фермента, наконец, по типу катализируемой реакции и характеру субстрата.
Примерами тривиальной номенклатуры могут служить названия таких ферментов, как пепсин (от греч. пепсис - пищеварение), трипсин (от греч. трипсис - разжижаю) и папаин (от названия дынного дерева Carica papaja, из сока которого он выделен).
Согласно современной номенклатуре название ферментов составляют из химического названия субстрата и названия той реакции, которая осуществляется ферментом. Если химическая реакция, ускоряемая ферментом, сопровождается переносом группировки атомов от субстрата к акцептору, название фермента включает также химическое наименование акцептора. Все ферменты имеют окончание «аза», прибавленное к названию субстрата.
Например, пируват - декарбоксил - аза, сукцинат - дегидроген - аза
Классификация ферментов.
В принятой классификации ферменты объединены в группы по типу важнейших биохимических процессов, лежащих в основе жизнедеятельности любого организма. По этому принципу все ферменты делят на 6 классов.
-
Оксидоредуктазы - ускоряют реакции окисления - восстановления.
-
Трансферазы - ускоряют реакции переноса функциональных групп и молекулярных остатков.
-
Гидролазы - ускоряют реакции гидролитического распада.
-
Лиазы - ускоряют негидролитическое отщепление от субстратов определенных групп атомов с образованием двойной связи (или присоединяют группы атомов по двойной связи).
-
Изомеразы - ускоряют пространственные или структурные перестройки в пределах одной молекулы.
-
Лигазы - ускоряют реакции синтеза, сопряженные с распадом богатых энергией связей.
-
Эти классы и положены в основу новой научной классификации ферментов.
Каждому ферменту присваивается индивидуальный номер (шифр). Например, шифр уреазы выражается цифрами 3.5.1.5. Это означает, что уреаза относится к 3-му классу (первая цифра) ферментов, все представители которого катализируют реакции гидролиза. Вторая цифра (5) говорит о том, что уреаза принадлежит к 5-му подклассу этого класса, куда зачислены все ферменты, ускоряющие гидролиз С - N-связей, не являющихся пептидными. Третья цифра шифра (1) указывает на принадлежность уреазы к подподклассу 5-го подкласса, члены которого ускоряют гидролиз линейных амидов, а последняя цифра (5) - порядковый номер уреазы в этом подподклассе.
Таким образом, шифр абсолютно точно указывает место фермента в общем списке. В настоящее время принято в научных публикациях при первом упоминании фермента указывать в скобках его шифр.
|
|
4. ЛОКАЛИЗАЦИЯ ФЕРМЕНТОВ В КЛЕТКЕ
В клеточном содержимом ферменты распределены не хаотически, а строго упорядоченно. С современной точки зрения клетка представляется высокоорганизованной системой, в отдельных частях которой осуществляются строго определенные биохимические процессы. В соответствии с приуроченностью их к определенным субклеточным частицам или отсекам (компартментам) клетки в них локализованы те или иные индивидуальные ферменты, мультиэнзимные комплексы, полифункциональные ферменты или сложнейшие метаболоны.
Разнообразные гидролазы и лиазы сосредоточены преимущественно в лизосомах. Внутри этих сравнительно небольших (несколько нанометров в диаметре) пузырьков, ограниченных мембраной от гиалоплазмы клетки, протекают процессы деструкции различных органических соединений до тех простейших структурных единиц, из которых они построены.
Сложные ансамбли окислительно-восстановительных ферментов, такие, например, как цитохромная система, находятся в митохондриях. В этих же субклеточных частицах локализован набор ферментов цикла дикарбоновых и трикарбоновых кислот. Ферменты активирования аминокислот распределены в гиалоплазме, но они же есть и в ядре. В гиалоплазме присутствуют многочисленные метаболоны гликолиза, структурно объединенные с таковыми пентозофосфатного цикла, что обеспечивает взаимопереключение дихотомического и апотомического путей распада углеводов.
В то же время ферменты, ускоряющие перенос аминокислотных остатков на растущий конец полипептидной цепи и катализирующие некоторые другие реакции в процессе биосинтеза белка, сосредоточены в рибосомальном аппарате клетки. Нуклеотидилтрансферазы, ускоряющие реакцию переноса нуклеотидных остатков при новообразовании нуклеиновых кислот, локализованы в основном в ядерном аппарате клетки. Таким образом, системы ферментов, сосредоточенные в тех или иных структурах, участвуют в осуществлении отдельных циклов реакций. Будучи тонко координированы друг с другом, эти отдельные циклы реакций обеспечивают жизнедеятельность клеток, органов, тканей и организма в целом.
ЭНЗИМОЛОГИЯ – МЕДИЦИНЕ
Нарушения структуры какого-либо фермента, ведущие к снижению его активности, приводят к нарушению метаболических путей, в которых участвует этот фермент. Такие нарушения почти всегда проявляются как болезни.
Повреждения ферментов бывают двух типов: наследственные дефекты строения фермента и повреждения, вызванные попадающими в организм токсическими веществами, ингибирующими фермент.
Нарушение синтеза фермента может привести к энзимопатиям, при которых недостаток одного фермента в метаболическом пути может вызвать нарушение образования конечного продукта. В силу взаимозависимости метаболических путей дефект одного фермента часто приводит к целому ряду нарушений в обмене веществ. Если фермент полностью отсутствует, то цепь реакций в таком месте разрывается. Существует вероятность, что избыточно накопленный субстрат может перейти на побочный путь метаболизма с образованием необычного и часто токсичного вещества.