ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.08.2021
Просмотров: 414
Скачиваний: 2
Ферменты
Фермент взаимодействует с субстратом и катализирует его превращение
Обмен веществ в организме можно определить как совокупность всех химических превращений, которым подвергаются соединения, поступающие извне. Эти превращения включают все известные виды химических реакций: межмолекулярный перенос функциональных групп, гидролитическое и негидролитическое расщепления химических связей, внутримолекулярная перестройка, новообразование химических связей и окислительно - восстановительные реакции. Такие реакции протекают в организме с чрезвычайно большой скоростью только в присутствии катализаторов.
Общее число видов ферментов, вероятно, приближается к 10 000. В это число входят не только ферменты, катализирующие 2000—3000 реакций обмена, но также и ферменты, вовлеченные в передачу сигнала, процесс дыхания, мышечное сокращение, свертываемость крови, транспорт веществ, обезвреживание токсичных и чужеродных соединений, нейротрансмиссию.
Ферменты имеют белковую природу, однако обнаружена способность некоторых молекул РНК осуществлять катализ. Такие РНК получили название «рибозимы».
Биосинтез ферментов находится под контролем генов. Различают конститутивные ферменты, постоянно присутствующие в клетках, и индуцируемые ферменты, биосинтез которых активируется под влиянием соответствующих субстратов.
Ферменты катализируют превращение веществ, которые называются субстратами (S), в продукты (Р).
Как и другие химические катализаторы, ферменты:
увеличивают скорость реакции, но не расходуются в ходе процесса и не претерпевают необратимых изменений;
не изменяют состояние равновесия химической реакции, ускоряя как прямую, так и обратную реакцию в равной степени;
повышают скорость реакции, понижая энергию активации, тот энергетический барьер, который отделяет одно состояние системы от другого.
при ферментативном катализе образованию продуктов предшествует образование фермент-субстратного комплекса (ES-комплекс), который через переходное состояние превращается в комплекс фермент-продукты (ЕР-комплекс), после чего происходит высвобождение продуктов. В общем виде уравнение ферментативного катализа записывается следующим образом: Е + S Е S ЕР Е+Р
Ферменты отличаются от небиологических катализаторов следующими свойствами:
высокой эффективностью действия - скорость ферментативных реакций обычно в 106 1012 раз выше, чем соответствующих неферментативных реакций;
высокой субстратной специфичностью — способностью взаимодействовать с определенным субстратом или группой субстратов;
высокой специфичностью действия – способностью катализировать специфическую реакцию;
мягкими условиями протекания ферментативных реакций: температура 37 °С, нормальное атмосферное давление, рН, близкое к нейтральному. В противоположность этому для эффективного химического катализа часто требуются высокие температура и давление, а также экстремальные значения рН;
способностью к регуляции. Каталитическая активность многих ферментов может изменяться в зависимости от концентрации веществ-регуляторов больше, чем в зависимости от концентрации их субстратов. Возможность регулирования активности ферментов делает их своеобразными организаторами обменных процессов в клетке.
1.Структурная организация ферментов
Ферменты – это глобулярные белки, состоящие из одной или нескольких полипептидных цепей, организованных в 3-х мерную структуру.
По химическому строению различают простые (однокомпонентные) ферменты (состоят только из аминокислот) и сложные двукомпонентные ферменты (имеющие небелковую часть - кофактор).
Кофакторы – это вещества, способствующие действию ферментов, или необходимые для его осуществления. Роль кофактора в основном сводится к следующему:
-
изменение третичной структуры белка и создание комплементарности между ферментом и субстратом, стабилизация молекулы фермента в пространстве;
-
непосредственное участие в реакции в качестве еще одного субстрата.
Кофакторы делят, хотя и достаточно условно, на коферменты и простетические группы.
Добавочную группу, прочно связанную, не отделяемую от белковой части, называют простетической группой; в отличие от этого добавочную группу, легко отделяющуюся от апофермента и способную к самостоятельному существованию, обычно именуют коферментом.
Химическая природа важнейших коферментов была выяснена в 30-е годы нашего столетия благодаря трудам О. Варбурга, Р. Куна, П. Каррера и др. Оказалось, что роль коферментов в двухкомпонентных ферментах играют большинство витаминов (Е, К, Q, В1, В2, В6 В12, Н и др.) или соединений, построенных с участием витаминов (коэнзим А, НАД+ и т. п.). Кроме того, функцию коферментов выполняют такие соединения, как НS-глутатион, многочисленная группа нуклеотидов и их производных, производные некоторых моносахаридов, ряд других веществ.
Характерной особенностью двухкомпонентных ферментов является то, что ни белковая часть, ни добавочная группа в отдельности не обладают заметной каталитической активностью. Только их комплекс проявляет ферментативные свойства. При этом белок резко повышает каталитическую активность добавочной группы, присущую ей в свободном состоянии в очень малой степени; добавочная же группа стабилизирует белковую часть и делает ее менее уязвимой к денатурирующим агентам.
В апоферменте есть участок, характеризующийся специфической структурой, избирательно связывающий кофермент. Это так называемый кофермент связывающий домен; его структура у различных апоферментов, соединяющихся с одним и тем же коферментом, очень сходна.
Каждый кофермент имеет определенную структуру, что делает его специфичным для определенного типа реакций (табл.1).
В процессе катализа реакции в контакт с субстратом вступает не вся молекула фермента, а определенный ее участок, который называется активным центром. Эта зона молекулы не состоит из последовательности аминокислот, а формируется при формировании третичной структуры белковой молекулы.
Активный центр — это относительно небольшой участок, расположенный в узком гидрофобном углублении (щели) поверхности молекулы фермента, непосредственно участвующий в связывании, удержании субстрата и катализе.
В активном центре различают две зоны: центр связывания (или субстратсвязывающий участок), ответственный за присоединение и удержание субстрата, и каталитический центр, отвечающий за химическое превращение субстрата (рис. 1). Необходимо понимать, что в реальных ферментах субстратный центр может совпадать (или перекрываться) с каталитическим центром. Более того, каталитический центр может окончательно формироваться в момент присоединения субстрата. Поэтому часто говорят об активном центре фермента, представляющем сочетание первого и второго.
Аллостерический (регуляторный) центр отвечает за активность фермента
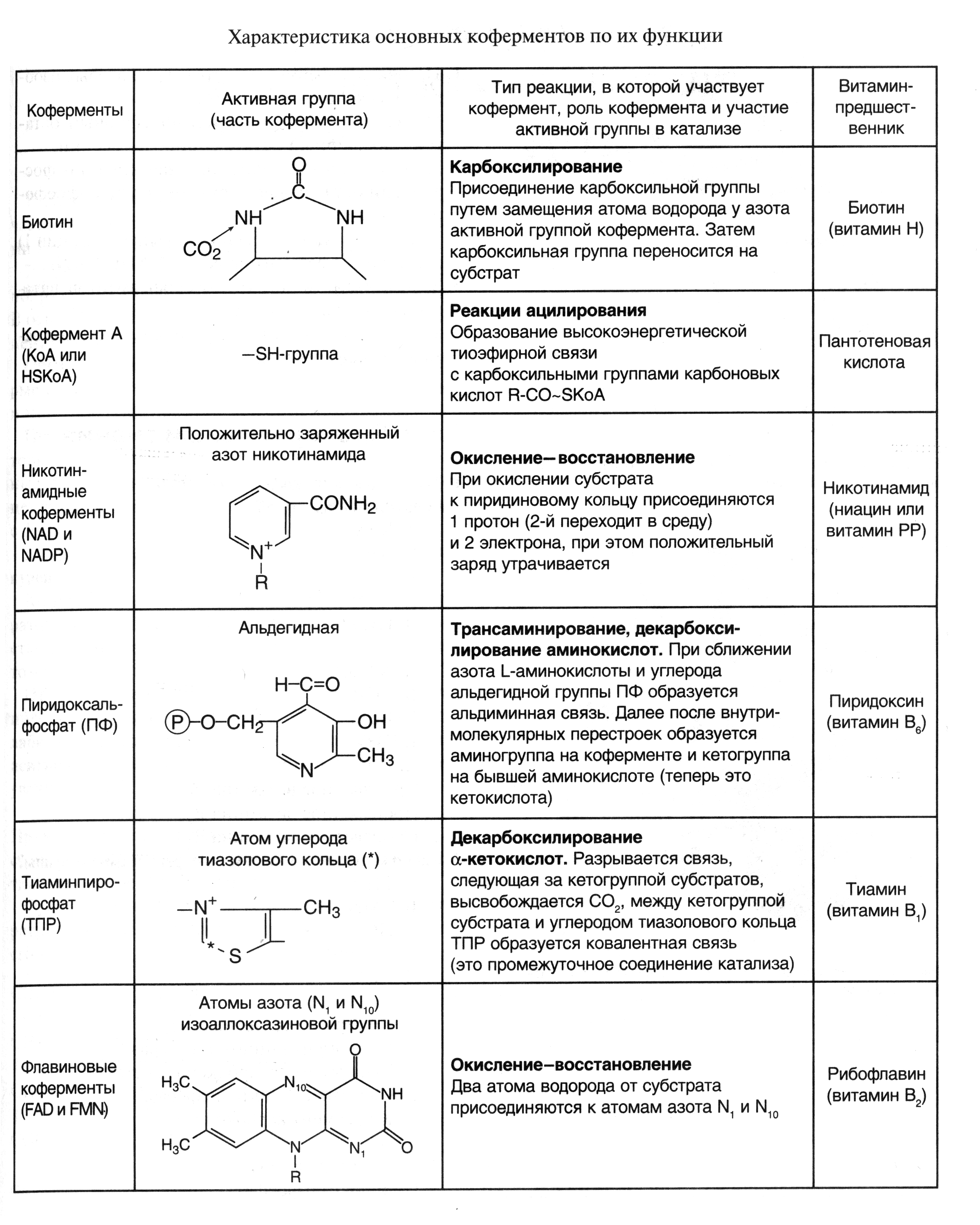
Таблица 1
Как уже указывалось, сложные ферменты в каталитическом центре имеют участок или домен для связывания кофактора.
Помимо активного центра ряд ферментов снабжен регуляторным центром. С этой зоной фермента взаимодействуют эффекторы, влияющие на его каталитическую активность.
Ферментативные эффекторы - вещества, изменяющие скорость ферментативного катализа. Среди них различают ингибиторы - замедляющие скорость реакции и активаторы - ускоряющие ферментативную реакцию.
2. СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ
Различают два главных вида специфичности ферментов: СУБСТРАТНУЮ СПЕЦИФИЧНОСТЬ и СПЕЦИФИЧНОСТЬ ДЕЙСТВИЯ.
Специфичность действия - это способность фермента катализировать только определенный тип химической реакции.
Субстратная специфичность - это способность фермента катализировать превращения только одного определенного субстрата или же группы сходных по строению субстратов. Определяется структурой адсорбционного участка активного центра фермента. Большинство ферментов высокоспецифично как к природе, так и к пути превращения субстрата. Специфичность к субстрату обусловлена комплементарностью структуры субстратсвязывающего центра фермента структуре субстрата.
Как показывает рис. 2, субстратсвязывающий участок по форме соответствует субстрату (геометрическое соответствие), более того, между аминокислотными остатками активного центра фермента и субстратом образуются специфические связи (гидрофобные, ионные и водородные), т.е. устанавливается электронное или химическое соответствие.
Связывание субстрата с активным центром фермента происходит многоточечно, с участием нескольких функциональных групп, которые далее могут участвовать в катализе.
Ферменты могут различаться по субстратной специфичности и обладать абсолютной специфичностью, т.е. действовать только на один субстрат и не взаимодействовать даже с очень близкими по строению молекулами (например, уреаза ускоряет гидролиз мочевины, но не действует на тиомочевину), или даже стереоспецифичностыо (когда фермент взаимодействует с определенным оптическим и геометрическим изомером).
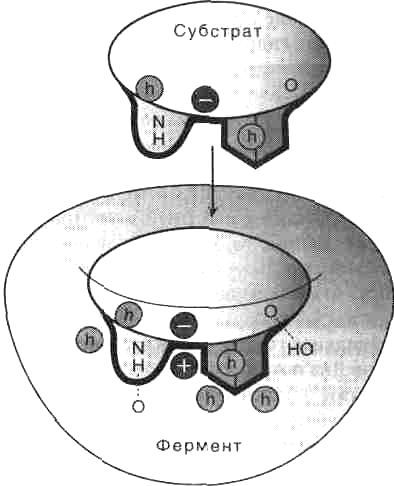
Рис. 2. Геометрическое и химическое соответствие (комплементарность) между ферментом и субстратом. h - гидрофобные группы, - водородные связи.
Некоторые ферменты проявляют более широкую специфичность (групповая или относительная специфичность) и взаимодействуют со многими веществами, имеющими похожую структуру (протеазы ускоряют гидролиз пептидных связей в белках, липазы ускоряют расщепление эфирных связей в липидах
Пример. Сериновые протеазы проявляют групповую специфичность к субстратам. Все они ускоряют гидролиз пептидных связей в белках, но, имея похожую структуру и каталитический механизм, различаются по субстратной специфичности.
|
|
|
|
|
В химотрипсине субстрат-связывающий участок представляет гидрофобный карман, который связывает радикалы ароматических аминокислот, таких, как фенилаланин. Этот фермент ускоряет гидролиз пептидных связей, образованных карбоксильной группой ароматических аминокислот. |
В трипсине отрицательный заряд остатка аспарагиновой кислоты в активном центре участвует как в связывании аминогруппы лизина (или гуанидиновой группы аргинина), так и непосредственно в катализе, при котором разрывается пептидная связь, в образовании которой участвует карбоксильная группа положительно заряженных остатков Лиз и Apr. |
В эластазе остатки валина и треонина, входящие в состав субстратсвязывающего центра, допускают связывание остатков аминокислот только с небольшими боковыми цепями, например, как у глицина. |
Рис. 3. Характеристика субстратсвязывающих центров сериновых протеаз. Стрелки — разрываемые связи в полипептидных цепях белков—субстратов. а — гидрофобный карман; б — ионная связь; в — небольшой гидрофобный карман.
Сравнительно недавно выявлена еще одна своеобразная черта в строении однокомпонентных ферментов: некоторые из них являются полифункциональными, т.е. обладают несколькими энзиматическими активностями, но всего лишь одной полипептидной цепью. Эта единая цепь при формировании третичной структуры образует несколько функционально и пространственно обособленных глобулярных участков - доменов, каждый из которых характеризуется своей каталитической активностью.
3. Общая характеристика ферментов - мультимеров
Большинство ферментов представлено белками – мультимерами, т.е. построенными из субъединиц. Например, РНК-полимераза состоит из 6 протомеров, ДНК-полимераза – из 2 протомеров.
Способы компоновки протомеров в мультимерах разнообразны. Крайне важно, что фермент проявляет максимальную каталитическую активность именно в виде мультимера: диссоциация на протомеры резко снижает активность фермента. Не все ферменты-мультимеры построены исключительно из каталитически активных протомеров. Наряду с каталитическими в их составе отмечены регуляторные субъединицы.
Среди ферментов-мультимеров безусловно преобладают димеры и тетрамеры (их несколько сотен), в меньшей мере распространены гексамеры и октамеры (несколько десятков) и редко встречаются тримеры и пентамеры.
Среди ферментов – мультимеров выделяют изoферменты, мультиэнзимы или полиферментные комплексы и мембраносвязанные ферменты.
Изоферменты — это формы фермента, которые катализируют одну и ту же реакцию, но различаются по некоторым свойствам: аминокислотной последовательности, молекулярной массе, аминокислотному составу, составу субъединиц, электрофоретической подвижности и др.
Изоферменты являются продуктами экспрессии разных генов: гены могут быть в разных хромосомах (например, для амилазы слюны и амилазы панкреатической) или в одной хромосоме (например, для цитоплазматической и митохондриальной малатде-гидрогеназы).
Существуют различия в распределении изоферментов в разных тканях, в разных внутриклеточных компартментах, что отражает различия в метаболизме, например изоферменты могут иметь разное сродство к субстрату.
Один из основных механизмов образования изоферментов включает объединение разных субъединиц в разной комбинации при образовании активного олигомерного фермента.
Пример 1. Изоферменты креатинкиназы (КК) образуются при объединении 2 субъединиц в димерную молекулу.
Креатинкиназа катализирует обратимую реакцию образования и распада креатинфосфата — вещества, которое участвует в запасании энергии.
Фермент КК является димером, состоящим из 2 субъединиц. Субъединицы В (мозговая) и М (мышечная) закодированы в разных генах.
Фермент КК представлен 3 изоферментами, которые различаются по электрофоретической подвижности:
— ВВ (КК-1) — мозговой, максимальное продвижение к аноду;
— MB (КК-2) — сердечный, средняя подвижность;
— ММ (КК-3) — мышечный, самый медленный. Набор изоформ КК в разных тканях неодинаков:
— КК-1 присутствует в значительных количествах в мозге, простате, желудке, легких, плаценте, щитовидной железе.
— КК-2 находится в основном в сердечной мышце (25-46% от общей активности фермента в кардиомиоците), в скелетной мышце (5%).
— КК-3 присутствует в основном в клетках скелетных и сердечной мышц.
Мультиэнзим или полиферментный комплекс образован за счет нековалентных взаимодействий, в его состав входит несколько индивидуальных ферментов; обычно эти ферменты функционально взаимосвязаны. Этот комплекс ферментов работает подобно конвейеру, в котором продукт передается от фермента к ферменту.
Примером может служить мультиэнзим, ускоряющий реакцию окислительного декарбоксилирования пировиноградной кислоты (рис.4). Этот полиферментный комплекс состоит из трех видов ферментов: пируватдекарбоксилазы (1), дигидролипоат-ацетилтрансферазы(2), дегидрогеназы дигидролипоевой кислоты (3).