ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 10.11.2023
Просмотров: 196
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ммиакты мынандай әр түрлі әдістермен алуға болады:
N2 + 3H2 = 2NH3;
NH4Cl + NaOH = NH3 + H2O + NaCl;
NH4Cl = NH3 + HCl.
Бұл реакциялар теңдеулерінен аммиак қандай әдістермен алынса да сапалық құрамы жағынан азот пен сутегіден, сандық құрамы жағынан бір атом азоттан және үш атом сутегіден тұратынын көруге болады. Сондықтан оның массасы және құрамындағы элементтердің проценттік мөлшерлері де тұрақты болады.
Құрамын сақтайтын қосылыстар – дальтонидтер, ал құрамын сақтамайтын қосылыстар бертолидтер деп аталды.
Еселік қатынас заңын Д. Дальтон ашты (1803 ж.). Егер екі элемент бір-бірімен бірнеше химиялық қосылыс түзсе, онда бір элемент мөлшерінің екінші элемент мөлшеріне қатынасы бүтін сандарға тең болады.Көміртегі оксидтері СО мен СО2-дегі көміртегінің 12 масса мөлшеріне келетін оттегі массаларының өзара қатынасы 16:32 = 1:2 қатынасындай болатынын аңықтау қиын емес.
Еселік қатынас заңынан молекулалық қосылысқа кіретін элементтің ең кіші бөлшегі атом екеніне көз жеткізуге болады. Мысалы көміртегі (II) оксидінде оттегінің 1 атомы болса, көміртегі (IV) оксидінде оттегінің 2 атомы болады.
Реакцияға қатысқан және оның нәтижесінде түзілген газдардың көлемдерін зерттей келіп француз ғалымы Гей-Люссак (1808 ж.) газдардың көлемдік қатынас заңын ашты. Реакцияға түсетін газдардың көлемдерінің түзілген газ өнімдерінің көлемдеріне қатынасы бүтін санға тең. 1 көлем сутегі мен 1 көлем хлор әрекеттесіп 2 көлем хлорсутек түзеді; екі көлем сутегі мен бір көлем оттегі әрекеттесіп 2 көлем су буын түзеді:
H2 + Cl2 = 2HCl;
2H2 + O2 = 2H2O.
Бойль-Мариот заңы: Тұрақты температурада берілген газ массасындағы газ қысымы мен көлемінің көбейтіндісі тұрақты шама болады:
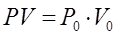 , егер
, егер 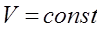 .
.
Гей-Люссак заңы: Тұрақты қысымда берілген газ массасындағы көлем абсолютті температураға тура пропорционал болады:
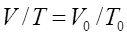 , егер
, егер 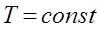
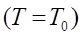
.
Шарль заңы: Тұрақты көлемде берілген газ массасындағы қысым абсолютті температураға тура пропорционал болады:
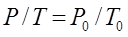 .
.
Үш параметрдің арасындағы қатынас Менделеев-Клайперон теңдеуімен сипатталады:
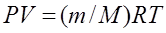 .
.
Мұндағы Р – газ қысымы;
V – газ көлемі;
Т – абсолюттік температура;
R – универсалды газ тұрақтысы;
m – газдың мольдік саны;
М – газдың молярлық массасы.
Авогадро заңы: 1811 жылы итальян физигі Авогадро химиялық реакцияларға түскен газдардың көлемдерінің қатынастарын зерттеп мынадай тұжырымдама жасады: Бірдей температура мен қысымда алынған кез келген газдардың бірдей көлеміндегі молекула сандары бірдей болады. Заңнан шығатын салдар:
1) Кез келген газдың 1 молі қалыпты жағдайда бірдей көлем алады. V = 22,4 дм3/моль.
2) Қалыпты жағдайда 1 моль газдың тұрақты көлеміндегі бөлшектердің саны Авогадро тұрақтысымен сипатталады: NA = 6,02·1023 моль-1.
Эквивалент дегеніміз – реакция кезінде орнын баса алатын, қосып алатын, бөліп шығаратын бір сутек ионының немесе тотығу-тотықсыздану реакциясы кезіндегі бір электрон эквивалентіне тең заттың бөлшегі.
Йодты сутекте HI сутегінің 1 молімен қосылып тұрғандықтан йодтың эквиваленті 1 мольге, күкіртті сутекте H2S cутегінің екі молімен қосылып тұрғандықтан күкірттің эквиваленті 1/2 мольге, аммиакта NH3 сутегінің үш молімен қосылып тұрғандықтан азоттың зквиваленті 1/3 мольге, силанда SiH4 сутегінің төрт молімен қосылып тұрғандықтан кремнийдің эквиваленті 1/4 мольгетең болады.
Эквиваленттер заңы: реакцияға түсетін заттардың массасы олардың эквиваленттеріне тура пропорционал болады.
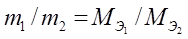 .
.
Егер әрекеттесуші заттар газ түрінде болса, онда эквиваленттер заңы былай өрнектеледі:
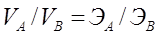 .
.
Мұндағы VА мен VВ – әрекеттесуші газдың көлемі.
Химиялық қосылыстың эквиваленті деп оның сутегінің немесе басқа заттың 1 эквивалентімен қалдықсыз әрекеттесетін мөлшерін айтады.
Заттың эквивалентін анықтау үшін химиялық реакция құрып, оның молекулалық массасын әрекеттесуші заттың эквивалент санына бөлу керек.
Алмасу реакциясына қатысатын негіздер мен қышқылдардың эквиваленттік массаларын олардың молярлық массаларын реакция кезінде жоғалтатын гидроксид немесе сутегінің иондарының сандарына бөлу арқылы табады:
NaOH + H2SO4 = NaHSO4 + H2O;
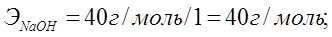
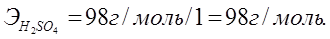
NaOH + H2SO4 = Na2SO4 + H2O,
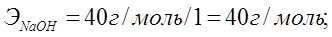
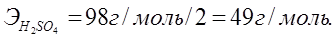
Дәріс №2
Атом құрылысы және периодтық заң
Дәрістің мақсаты: атомның электрондық құрылысын және периодтық заңды зерттеу.
Э. Резерфорд атом құрылысының моделін ұсынды. Бұл модельді атомның ядролық немесе планеталық моделі деп атады. Өйткені, атом құрылысы Күн жүйесіне ұқсас деп қарастырылды. Бірақ бұл модель атом құрылысының орнықты күйін және олардан шығатын сәулелердің қарқынын классикалық физика ұғымдары аясында түсіндіре алмады. Сондықтан Резерфорд моделі мен классикалық физика арасындағы айтылған қайшылықтарды шешу үшін 1913 ж. Н. Бор өз қағидаларын ұсынды.
Француз ғалымы А. Беккерель 1896 жылы Рентген сәулелерін зерттеумен шұғылданды. Зерттеу барысында кейбір минералдардың сәуле шығаратынын байқаған. Бұл зерттеу нәтижелері радиоактивтілік құбылысының ашылуына себеп болды.
Электронның кеңістіктегі орны оның энергетикалық күйіне байланысты болады. Электронның болу мүмкіндігінің максимал шамасы орбиталь деп аталады. Электронның орнын сақтау үшін бүтін сандар алынады. Ол сандар квант сандары деп аталады.
Бас квант саны n 1, 2, 3...∞ мәндері болады. Ол электронның энергиясын және орбитальдың өлшемін анықтайды. n = 1 болғанда электронның энергетикалық күйі ең төменгі денгейге сәйкес келеді. Электрондық қабат саны артқан сайын энергия да артады. Сондықтан атомдағы орбитальдар белгілі бір энергетикалық деңгейге бөлінеді. Ол энергетикалық деңгейлерді кейде K, L, M, N, O, P, Q – латын алфавитінің әріптерімен белгілейді.
Қосымша квант саны – l, орбитальдың кеңістіктегі пішінін сипаттайды. Сонымен бірге белгілі бір деңгейдегі электронның әртүрлі энергетикалық жағдайын анықтайды. 1, 0, 1, 2...n – 1 мәндері болады. Қосымша квант санының әртүрлі мәндерін ажырату үшін латын әріптерімен белгілеу қабылданған: s (l = 0), р (l = 1), d (l = 2), f (l = 3), g (l = 4). Қосымша квант саны l-дың әртүрлі мәндеріндегі электронның пішіні әртүрлі болады, оларды энергетикалық деңгейшелер деп атайды; n = 1, болғанда l = 0, 1; демек І-деңгейде 2 электрон, ол электрон 1s-ке толтырылады; n = 2, l = 0, 1; яғни ІІ-деңгейде 6 электрон болады, олар 2s 2p-ға толтырылады; n = 3, l = 0, 1, 2; ІІІ-деңгейде 18 электрон болады, олар 3s 3p 3d-ға толтырылады; n = 4, l = 0, 1, 2, 3; IV-деңгейде 18 электрон болады, олар 4s 4p 4d 4f-ке орналасады.
Магнит квант саны ml. Орбитальдардың кеңістікте бағытталуын сипаттайды. Электрон орбитальда қозғалғанда магнит өрісін тудырады. Оның мәндері m
l = – l,…0,…+ l.
Кеңістікте бағытталуын анықтау үшін (2l + 1) формуласын қолданады. l = 0; ml = 0; болса, (s-орбиталь) кеңістікте пішіні шар тәрізді болады, l = 1 (р-орбиталь); ml = – 1, 0, 1 кезінде орбитальдың бағытталуы үш түрлі, яғни 3-орбитальға 6-электрон орналаса алады.
Шредингер теңдеуін шешу үшін енгізілген 3 квант саны жеткіліксіз, сондықтан, 4-ші квант саны енгізілді, ол спин квант саны деп аталады, ms әрпімен белгіленеді. Спин дегеніміз –электронның кеңістіктегі қозғалысына байланыссыз, оның өзіндік импульс моментін сипаттайтын шама.
Атомдағы электрондардың энергетикалық деңгейлерге орналасу ретін көрсететін формуланы атомның электрондық конфигурациясы немесе атомның электрондық формуласы деп атайды.
Атомдағы электрондық қабаттардың құрылысын, электрондық конфигурациясын толық түсіну үшін негізгі 4 ұстанымды білу керек:
1) Паули қағидасы.
2) Ең аз энергия ұстанымы.
3) Гунд ережесі.
4) Клечковский ережесі.
1925 жылы Швейцар физигі В. Паули мынадай қағида ұсынды. Атомда бірдей қасиет көрсететін екі электрон болуы мүмкін емес. Электрондық қасиеттері квант сандарымен сипатталатын болғандықтан Паули қағидасы: атомда 4 квант сандары бірдей екі электрон болуы мүмкін емес деп сипатталады. Яғни, бір атомдық орбитальда екі электроннан артық электрон бола алмайды және олардың спиндері қарама-қарсы болуы қажет. Квант санының біреуі n, l, ml, ms спиндері әртүрлі болуы керек. n, l, ml бірдей болғанмен, ms = +1/2; –1/2 болуы мүмкін. Паули қағидасы бойынша: n = 1, l = 0, ml = 1 болса, ms = +1/2; –1/2 болады. Спиндері қарама-қарсы орналасқан екі электрон болуы мүмкін. Орбитальдағы электрондар санын N = 2n2 формуласымен анықтайды.
І-деңг. n = 1, N = 2.
II-деңг. n = 2, N = 8.
III-деңг. n = 3, N = 18.
1Н (1s) атомының электрондық конфигурациясын былай көрсетуге болады: электрондық формуласы – 1s1. Квант ұяшықтарында Паули қағидасы бойынша 2 электрон спиндері бір-біріне ешқашан параллель болмайды.
3Lі 1s2 2s1
Спиндердің орналасуы Гунд ережесімен анықталады: Қосымша квант санының берілген мәнінде электрондар спиндерінің қосындысы ең жоғарғы мән болатындай орналасады. Гунд ережесі бойынша р-электрондар орбитальдарға орналасқанда ең алдымен жеке-жеке ұяшықтарға толтырылады, содан кейін ғана қарсы спинмен алғашқы электронға параллель орналасады. Бұл жағдайда спиндердің қосындысы 3/2 болады.
N2 + 3H2 = 2NH3;
NH4Cl + NaOH = NH3 + H2O + NaCl;
NH4Cl = NH3 + HCl.
Бұл реакциялар теңдеулерінен аммиак қандай әдістермен алынса да сапалық құрамы жағынан азот пен сутегіден, сандық құрамы жағынан бір атом азоттан және үш атом сутегіден тұратынын көруге болады. Сондықтан оның массасы және құрамындағы элементтердің проценттік мөлшерлері де тұрақты болады.
Құрамын сақтайтын қосылыстар – дальтонидтер, ал құрамын сақтамайтын қосылыстар бертолидтер деп аталды.
Еселік қатынас заңын Д. Дальтон ашты (1803 ж.). Егер екі элемент бір-бірімен бірнеше химиялық қосылыс түзсе, онда бір элемент мөлшерінің екінші элемент мөлшеріне қатынасы бүтін сандарға тең болады.Көміртегі оксидтері СО мен СО2-дегі көміртегінің 12 масса мөлшеріне келетін оттегі массаларының өзара қатынасы 16:32 = 1:2 қатынасындай болатынын аңықтау қиын емес.
Еселік қатынас заңынан молекулалық қосылысқа кіретін элементтің ең кіші бөлшегі атом екеніне көз жеткізуге болады. Мысалы көміртегі (II) оксидінде оттегінің 1 атомы болса, көміртегі (IV) оксидінде оттегінің 2 атомы болады.
Реакцияға қатысқан және оның нәтижесінде түзілген газдардың көлемдерін зерттей келіп француз ғалымы Гей-Люссак (1808 ж.) газдардың көлемдік қатынас заңын ашты. Реакцияға түсетін газдардың көлемдерінің түзілген газ өнімдерінің көлемдеріне қатынасы бүтін санға тең. 1 көлем сутегі мен 1 көлем хлор әрекеттесіп 2 көлем хлорсутек түзеді; екі көлем сутегі мен бір көлем оттегі әрекеттесіп 2 көлем су буын түзеді:
H2 + Cl2 = 2HCl;
2H2 + O2 = 2H2O.
Бойль-Мариот заңы: Тұрақты температурада берілген газ массасындағы газ қысымы мен көлемінің көбейтіндісі тұрақты шама болады:
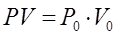 , егер
, егер Гей-Люссак заңы: Тұрақты қысымда берілген газ массасындағы көлем абсолютті температураға тура пропорционал болады:
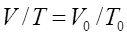 , егер
, егер 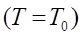
.
Шарль заңы: Тұрақты көлемде берілген газ массасындағы қысым абсолютті температураға тура пропорционал болады:
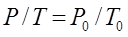 .
. Үш параметрдің арасындағы қатынас Менделеев-Клайперон теңдеуімен сипатталады:
Мұндағы Р – газ қысымы;
V – газ көлемі;
Т – абсолюттік температура;
R – универсалды газ тұрақтысы;
m – газдың мольдік саны;
М – газдың молярлық массасы.
Авогадро заңы: 1811 жылы итальян физигі Авогадро химиялық реакцияларға түскен газдардың көлемдерінің қатынастарын зерттеп мынадай тұжырымдама жасады: Бірдей температура мен қысымда алынған кез келген газдардың бірдей көлеміндегі молекула сандары бірдей болады. Заңнан шығатын салдар:
1) Кез келген газдың 1 молі қалыпты жағдайда бірдей көлем алады. V = 22,4 дм3/моль.
2) Қалыпты жағдайда 1 моль газдың тұрақты көлеміндегі бөлшектердің саны Авогадро тұрақтысымен сипатталады: NA = 6,02·1023 моль-1.
Эквивалент дегеніміз – реакция кезінде орнын баса алатын, қосып алатын, бөліп шығаратын бір сутек ионының немесе тотығу-тотықсыздану реакциясы кезіндегі бір электрон эквивалентіне тең заттың бөлшегі.
Йодты сутекте HI сутегінің 1 молімен қосылып тұрғандықтан йодтың эквиваленті 1 мольге, күкіртті сутекте H2S cутегінің екі молімен қосылып тұрғандықтан күкірттің эквиваленті 1/2 мольге, аммиакта NH3 сутегінің үш молімен қосылып тұрғандықтан азоттың зквиваленті 1/3 мольге, силанда SiH4 сутегінің төрт молімен қосылып тұрғандықтан кремнийдің эквиваленті 1/4 мольгетең болады.
Эквиваленттер заңы: реакцияға түсетін заттардың массасы олардың эквиваленттеріне тура пропорционал болады.
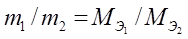 .
. Егер әрекеттесуші заттар газ түрінде болса, онда эквиваленттер заңы былай өрнектеледі:
Мұндағы VА мен VВ – әрекеттесуші газдың көлемі.
Химиялық қосылыстың эквиваленті деп оның сутегінің немесе басқа заттың 1 эквивалентімен қалдықсыз әрекеттесетін мөлшерін айтады.
Заттың эквивалентін анықтау үшін химиялық реакция құрып, оның молекулалық массасын әрекеттесуші заттың эквивалент санына бөлу керек.
Алмасу реакциясына қатысатын негіздер мен қышқылдардың эквиваленттік массаларын олардың молярлық массаларын реакция кезінде жоғалтатын гидроксид немесе сутегінің иондарының сандарына бөлу арқылы табады:
NaOH + H2SO4 = NaHSO4 + H2O;
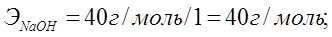
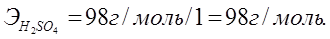
NaOH + H2SO4 = Na2SO4 + H2O,
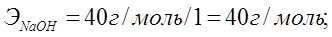
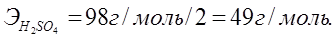
Дәріс №2
Атом құрылысы және периодтық заң
Дәрістің мақсаты: атомның электрондық құрылысын және периодтық заңды зерттеу.
-
Атом құрылысы. -
Периодтық заң.
Э. Резерфорд атом құрылысының моделін ұсынды. Бұл модельді атомның ядролық немесе планеталық моделі деп атады. Өйткені, атом құрылысы Күн жүйесіне ұқсас деп қарастырылды. Бірақ бұл модель атом құрылысының орнықты күйін және олардан шығатын сәулелердің қарқынын классикалық физика ұғымдары аясында түсіндіре алмады. Сондықтан Резерфорд моделі мен классикалық физика арасындағы айтылған қайшылықтарды шешу үшін 1913 ж. Н. Бор өз қағидаларын ұсынды.
Француз ғалымы А. Беккерель 1896 жылы Рентген сәулелерін зерттеумен шұғылданды. Зерттеу барысында кейбір минералдардың сәуле шығаратынын байқаған. Бұл зерттеу нәтижелері радиоактивтілік құбылысының ашылуына себеп болды.
Электронның кеңістіктегі орны оның энергетикалық күйіне байланысты болады. Электронның болу мүмкіндігінің максимал шамасы орбиталь деп аталады. Электронның орнын сақтау үшін бүтін сандар алынады. Ол сандар квант сандары деп аталады.
Бас квант саны n 1, 2, 3...∞ мәндері болады. Ол электронның энергиясын және орбитальдың өлшемін анықтайды. n = 1 болғанда электронның энергетикалық күйі ең төменгі денгейге сәйкес келеді. Электрондық қабат саны артқан сайын энергия да артады. Сондықтан атомдағы орбитальдар белгілі бір энергетикалық деңгейге бөлінеді. Ол энергетикалық деңгейлерді кейде K, L, M, N, O, P, Q – латын алфавитінің әріптерімен белгілейді.
Қосымша квант саны – l, орбитальдың кеңістіктегі пішінін сипаттайды. Сонымен бірге белгілі бір деңгейдегі электронның әртүрлі энергетикалық жағдайын анықтайды. 1, 0, 1, 2...n – 1 мәндері болады. Қосымша квант санының әртүрлі мәндерін ажырату үшін латын әріптерімен белгілеу қабылданған: s (l = 0), р (l = 1), d (l = 2), f (l = 3), g (l = 4). Қосымша квант саны l-дың әртүрлі мәндеріндегі электронның пішіні әртүрлі болады, оларды энергетикалық деңгейшелер деп атайды; n = 1, болғанда l = 0, 1; демек І-деңгейде 2 электрон, ол электрон 1s-ке толтырылады; n = 2, l = 0, 1; яғни ІІ-деңгейде 6 электрон болады, олар 2s 2p-ға толтырылады; n = 3, l = 0, 1, 2; ІІІ-деңгейде 18 электрон болады, олар 3s 3p 3d-ға толтырылады; n = 4, l = 0, 1, 2, 3; IV-деңгейде 18 электрон болады, олар 4s 4p 4d 4f-ке орналасады.
Магнит квант саны ml. Орбитальдардың кеңістікте бағытталуын сипаттайды. Электрон орбитальда қозғалғанда магнит өрісін тудырады. Оның мәндері m
l = – l,…0,…+ l.
Кеңістікте бағытталуын анықтау үшін (2l + 1) формуласын қолданады. l = 0; ml = 0; болса, (s-орбиталь) кеңістікте пішіні шар тәрізді болады, l = 1 (р-орбиталь); ml = – 1, 0, 1 кезінде орбитальдың бағытталуы үш түрлі, яғни 3-орбитальға 6-электрон орналаса алады.
Шредингер теңдеуін шешу үшін енгізілген 3 квант саны жеткіліксіз, сондықтан, 4-ші квант саны енгізілді, ол спин квант саны деп аталады, ms әрпімен белгіленеді. Спин дегеніміз –электронның кеңістіктегі қозғалысына байланыссыз, оның өзіндік импульс моментін сипаттайтын шама.
Атомдағы электрондардың энергетикалық деңгейлерге орналасу ретін көрсететін формуланы атомның электрондық конфигурациясы немесе атомның электрондық формуласы деп атайды.
Атомдағы электрондық қабаттардың құрылысын, электрондық конфигурациясын толық түсіну үшін негізгі 4 ұстанымды білу керек:
1) Паули қағидасы.
2) Ең аз энергия ұстанымы.
3) Гунд ережесі.
4) Клечковский ережесі.
1925 жылы Швейцар физигі В. Паули мынадай қағида ұсынды. Атомда бірдей қасиет көрсететін екі электрон болуы мүмкін емес. Электрондық қасиеттері квант сандарымен сипатталатын болғандықтан Паули қағидасы: атомда 4 квант сандары бірдей екі электрон болуы мүмкін емес деп сипатталады. Яғни, бір атомдық орбитальда екі электроннан артық электрон бола алмайды және олардың спиндері қарама-қарсы болуы қажет. Квант санының біреуі n, l, ml, ms спиндері әртүрлі болуы керек. n, l, ml бірдей болғанмен, ms = +1/2; –1/2 болуы мүмкін. Паули қағидасы бойынша: n = 1, l = 0, ml = 1 болса, ms = +1/2; –1/2 болады. Спиндері қарама-қарсы орналасқан екі электрон болуы мүмкін. Орбитальдағы электрондар санын N = 2n2 формуласымен анықтайды.
І-деңг. n = 1, N = 2.
II-деңг. n = 2, N = 8.
III-деңг. n = 3, N = 18.
1Н (1s) атомының электрондық конфигурациясын былай көрсетуге болады: электрондық формуласы – 1s1. Квант ұяшықтарында Паули қағидасы бойынша 2 электрон спиндері бір-біріне ешқашан параллель болмайды.
3Lі 1s2 2s1
Спиндердің орналасуы Гунд ережесімен анықталады: Қосымша квант санының берілген мәнінде электрондар спиндерінің қосындысы ең жоғарғы мән болатындай орналасады. Гунд ережесі бойынша р-электрондар орбитальдарға орналасқанда ең алдымен жеке-жеке ұяшықтарға толтырылады, содан кейін ғана қарсы спинмен алғашқы электронға параллель орналасады. Бұл жағдайда спиндердің қосындысы 3/2 болады.