ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 22.11.2023
Просмотров: 49
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
2.2.3. Азот и Фосфор
План.
1. Азот как химический элемент и простое вещество
2. Аммиак и соли аммония.
3. Оксиды азота. Азотная кислота и ее соли.
4. Кругооборот азота в природе. Значение азота для живых организмов.
5. Фосфор как химический элемент и простое вещество.
6. Соединения фосфора с отрицательной степенью окисления.
7. Оксиды фосфора. Фосфорная кислота и ее соли.
8. Кругооборот фосфора в природе. Значение фосфора для живых организмов.
1. Азот (Нитроген) как химический элемент. Положение в ПС: №7, 2 период, 5-А группа, Аr = 14. Состав атома: 7p, 7e-, 7n. Заряд ядра +7, два электронных слоя: 2e-, 5e-. Электронная формула 1s2 2s2 2p3.
На внешнем слое 5 электронов, слой не завершён, но заполнен больше чем наполовину, радиус атома маленький (всего два слоя) => высокая ЭО, азот типичный неметалл. Характерна отрицательная степень окисления -3, положительные степени окисления проявляют в соединениях с кислородом и фтором (+1, +2, +3, +4, +5). Три e- неспаренные, => характерная валентность (III), но наличие не поделенной пары электронов делает возможным образование еще одной ковалентной связи по донорно-акцепторному механизму. Т.е. максимальная валентность азота равна четырем.
Распространение азота в природе: 0,04% по массе на Земле. В природе встречается в основном в свободном состоянии (в воздухе - 78% по объему); неорганических минералов практически не образует. Органоген, в организме человека содержится 3,1% по массе, входит в состав всех белков, нуклеиновых кислот и некоторых липидов.
Азот как простое вещество. Имеет молекулярное строение: N2 или N ≡ N. Химическая связь ковалентная неполярная, очень прочная, т.к. образована тремя парами электронов. Даже при 3000оС распадается одна из тысячи молекул азота.
Физические свойства: Газ, без цвета, запаха и вкуса. Температура кипения -196оС, плавления -210оС. Плохо растворим в воде. Немного легче воздуха.
 Химические свойства: Типичный неметалл, может быть и окислителем, и восстановителем, но окислительные свойства преобладают. Инертен (химически малоактивен).
Химические свойства: Типичный неметалл, может быть и окислителем, и восстановителем, но окислительные свойства преобладают. Инертен (химически малоактивен).Как окислитель взаимодействует с металлами и водородом
N2 + Mg
 Mg3N2 – нитрид магния (при нагревании)
Mg3N2 – нитрид магния (при нагревании)N2 + Li → Li3N – нитрид лития (при н.у.)
N2 + H2↔ NH3 – аммиак (температура 500оС, повышенное давление, катализатор платина):
Как восстановитель взаимодействует с кислородом:
N2 + O2→ NO – оксид азота (II) (температура более 3000оС, электрический разряд). Никаких других оксидов при взаимодействии с кислородом не образует.
Получение азота:
1) в промышленности из воздуха (фракционная перегонка);
2) в лаборатории чаще всего термическим разложением нитрита аммония: NH4NO2 = N2 + H2O
Применение:
1) газообразный азот используют для создания инертной атмосферы (плавление металлов, перекачка топлива, электрические лампы…);
2) жидкий азот используют в криогенной технике для создания низких температур (медицина – кожные заболевания, хранение органов и тканей, пищевая промышленность – продукты глубокой заморозки, техника – холодильники, явления сверхпроводимости и сверхтекучести…);
3) азот используют для получения аммиака, а из аммиака получает все азотсодержащие неорганические и органические вещества.
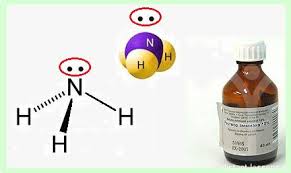
2. Аммиак. Строение молекулы: NH3
Форма молекулы – треугольная пирамида, связи ковалентные полярные, электронная плотность смещена к азоту, у азота неподеленная пара электронов, высокая ЭО => молекула аммиака является диполем, т.е. полярная. Между молекулами существует достаточно сильное взаимодействие, образуются водородные связи.
Физические свойства: При н.у. аммиак - газ, бесцветный, с резким характерным запахом. Температура кипения 33,5оС ниже нуля, температура плавления минус 78оС. При повышенном давлении легко сжижается, при испарении поглощает много тепла. Очень хорошо растворим в воде (при 20оС в 1л растворяется 700л аммиака, насыщенный раствор имеет массовую долю аммиака 25%) и во многих органических растворителях. Сам аммиак тоже используют как растворитель. Аммиак намного легче воздуха. Физиологическое действие: раздражает слизистые, рецепторы верхних дыхательных путей, при высокой концентрации может вызвать отек легких, нарушает проводимость нервной ткани, возникают судороги и парализуется работа дыхательной системы, происходит сосудистый коллапс и кома. При попадании аммиака или его концентрированных растворов в ЖКТ происходит химический ожог слизистых и перфорация тканей желудка.
Х
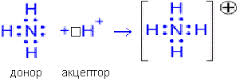 имические свойства:
имические свойства: 1
 ) Аммиак проявляет свойства оснований. Неподеленная пара электронов азота и его высокая ЭО приводит к тому, что молекула аммиака может присоединить протон. Ион водорода имеет вакантную орбиталь и образует с азотом ковалентную полярную связь по донорно-акцепторному механизму. Поэтому при взаимодействии с водой (растворении) происходит процесс: NH3 + H2O ↔ NH4+ + OH-
) Аммиак проявляет свойства оснований. Неподеленная пара электронов азота и его высокая ЭО приводит к тому, что молекула аммиака может присоединить протон. Ион водорода имеет вакантную орбиталь и образует с азотом ковалентную полярную связь по донорно-акцепторному механизму. Поэтому при взаимодействии с водой (растворении) происходит процесс: NH3 + H2O ↔ NH4+ + OH- и
 в растворе появляется избыток ионов гидроксила, т.е. щелочная среда. Раствор аммиака в воде является щелочью, т.е. растворимым основанием. Но это слабый электролит, равновесие смещено в сторону молекул аммиака (Кд = 10-5). Водный раствор аммиака называют иногда гидроксидом аммония, это слабое и нестойкое основание, оно существует только в растворе, поэтому формулу [NH4OH] обычно пишут в квадратных скобках, имея в виду ее условность. Но не только раствор аммиака, но и сам аммиак может давать реакции характерные для оснований. Например, аммиак взаимодействует с кислотами, и при этом образуются соли.
в растворе появляется избыток ионов гидроксила, т.е. щелочная среда. Раствор аммиака в воде является щелочью, т.е. растворимым основанием. Но это слабый электролит, равновесие смещено в сторону молекул аммиака (Кд = 10-5). Водный раствор аммиака называют иногда гидроксидом аммония, это слабое и нестойкое основание, оно существует только в растворе, поэтому формулу [NH4OH] обычно пишут в квадратных скобках, имея в виду ее условность. Но не только раствор аммиака, но и сам аммиак может давать реакции характерные для оснований. Например, аммиак взаимодействует с кислотами, и при этом образуются соли.NH3 + HCl ↔ NH4Cl – хлорид аммония
NH3 + HNO3 ↔ NH4NO3…
2
 ) Аммиак в ОВР всегда ведет себя как восстановитель (азот в нем находится в самой низкой для него с.о.). Наиболее важные реакции такого типа — это взаимодействие аммиака с кислородом и восстановление им оксидов металлов.
) Аммиак в ОВР всегда ведет себя как восстановитель (азот в нем находится в самой низкой для него с.о.). Наиболее важные реакции такого типа — это взаимодействие аммиака с кислородом и восстановление им оксидов металлов.А) NH3 + O2→ N2 + H2O – горение
Б) NH3 + O2→ NO + H2O – каталитическое окисление, Pt
В) NH3 + CuO→ N2 + H2O + Cu
Г) NH3 + Fe2O3 → N2 + H2O + Fe
Получение:
1) в промышленности – синтез из простых веществ
N2 + 3H2↔ 2NH3 + Q – эта реакция обратимая, экзотермическая, гомогенная
Оптимальные условия процесса (по принципу Ле Шателье):
А) 4 моль ↔ 2 моль, т.е. в прямой реакции давление уменьшается, в обратной – увеличивается => необходимо повысить давление, чтобы сместить равновесие в сторону образования аммиака;
Б) прямая реакция экзотермическая, обратная – эндотермическая, значит нельзя использовать очень высокую температуру, чтобы равновесие не сместилось к простым веществам, но, чтобы
скорость реакции была достаточно большой, надо повысить температуру хотя бы до 450-500оС;
В) эта реакция каталитическая и протекает только в присутствии катализатора, идеально – платины, но чаще используют губчатое железо с примесями Al2O3 и K2O.
О
 сновные принципы производства аммиака:
сновные принципы производства аммиака: - принцип теплообмена;
- принцип циркуляции.
Применение:
1) жидкий аммиак как хладагент в холодильниках;
2) водный раствор аммиака:
- 10% раствор называют «нашатырным спиртом» и используют в медицине (потеря сознания, алкогольное отравление, обработка рук и инструмента, стеклянной посуды…), в домашнем хозяйстве (стирка, мытье окон, выведение пятен, чистка ковров, ювелирных изделий…);
- разбавленный раствор – как азотное удобрение;
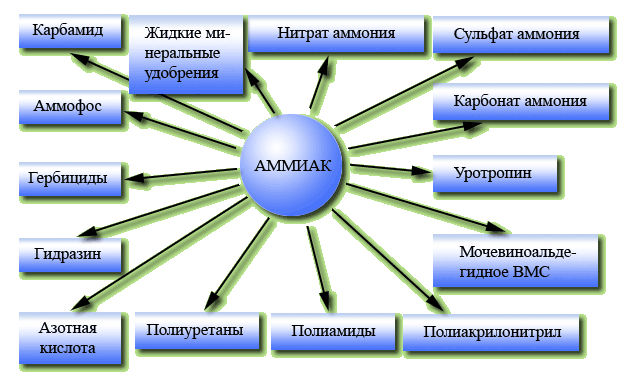
3) аммиак – сырье для получения минеральных удобрений (карбамид, аммиачная селитра и т.д.), анилина (красители, нитробензол, лаки, краски, ВВ и т.д.), азотной кислоты и ее солей, соды и т.д. Именно с этого вещества начинается получение ВСЕХ органических и неорганических соединений, которые использует человек.
Соли аммония. Ион NH4+ ведет себя как ионы К+ или Na+, т.е. образует соли, хорошо растворимые в воде, сильные электролиты. Например: (NH4)2SO4↔ 2NH4+ + SO42-
С
 оли аммония нестойкие, разлагаются при нагревании, продукты разложения могут быть разными, в зависимости от природы аниона и температуры. Например:
оли аммония нестойкие, разлагаются при нагревании, продукты разложения могут быть разными, в зависимости от природы аниона и температуры. Например:1) NH4Cl ↔ NH3↑+ HCl ↑, при незначительном нагревании;
2) NH4NO3 →N2О + H2O, при нагревании до 250оС.
Ион аммония в растворе можно определить по запаху образующегося аммиака, если добавить в раствор щелочь и нагреть (качественная реакция):
NH4Cl + NaOH → NH3↑+H2O + NaCl
Получают соли аммония при взаимодействии аммиака с кислотами (см. выше).
Применение:
1) минеральные удобрения: аммиачная селитра – нитрат аммония NH4NO3, сульфат аммония - (NH4)2SO4, и аммофос – смесь фосфата и гидрофосфатов аммония, смесь нитрата и фосфата калия - нитрофоска и т.д. Последние два вида удобрений называют сложными, потому что они содержат несколько питательных элементов.
2) NH4Cl под названием «нашатырь» используют для пайки и лужения металлов, для крашения тканей, в гальванических элементах.
3) NH4NO3 образует взрывчатые смеси с горючими веществами (под названием «аммонал»).
3. Оксиды азота. N2O, NO, N2O3, NO2, N2O5.
N2O – оксид азота (I), закись азота, веселящий газ. Бесцветный газ, сладковатый запах, tкип.= -89оС, мало растворим в воде. Несолеобразующий (не взаимодействует ни с кислотами, ни со щелочами). Обладает выраженным физиологическим действием: в небольших количествах притупляет болевую чувствительность, в больших – возбуждает нервную систему. Азот со с.о. +1 проявляет свойства окислителя, например:
1) N2O = N2 +О2, разлагается при нагревании до 700оС;
2) N2O + Н2 = N2 + H2O
Получение: NH4NO3 →N2О+ H2O, при нагревании до 250оС.
NO– оксид азота (II). Газ без цвета и запаха, tкип.= -152оС, мало растворим в воде. Несолеобразующий. В ОВР может быть и окислителем, и восстановителем, химически очень активен, является свободным радикалом (O=N∙). Например:
1) NO + SO2 → N2 + SO3 - как окислитель
2) NO + О2→ NO2 – как восстановитель, при н.у.
Получение:
1) в промышленности: NH3 + O2→ NO + H2O – каталитическое окисление аммиака, Pt
или окисление азота при температуре более 3000оС (электрический разряд): N2 + O2→ NO
2) в лаборатории HNO3(paзб.) + Cu → Cu(NO3)2 + NO + H2O
N2O3 – оксид азота (III). Газ, при температуре 3,5оС превращается в темно-синюю жидкость. Очень нестойкое соединение, при н.у. N2O3 ↔ NO +NO2, т.е. диспропорционирует, N2O3 проявляет и окислительные и восстановительные свойства.
Кислотный оксид:
N2O3 + H2O → HNО2 – азотистая кислота, слабая, существует только в растворах.
N2O3+ NаОН → NаNO2+ H2O – нитрит натрия, соль азотистой кислоты.
NO2 – оксид азота (IV), бурый газ. Газ с характерным резким запахом, желто-коричневого (бурого) цвета. tкип.= 2оС. Очень токсичен. Химически очень активен, является свободным радикалом: (O=N∙=O).
Хорошо растворяется в воде, взаимодействует с ней образуя две кислоты, т.е. это кислотный оксид: