Файл: Занятие 1 Тема 1 Растворы и их роль в жизнедеятельности Дайте краткий ответ на теоретические вопросы.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.11.2023
Просмотров: 262
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
лиофильность). Неполярные полимеры хорошо набухают (растворяются) в неполярных растворителях (каучук в бензоле или бензине) и не набухают в полярных. Полярные полимеры лучше набухают (растворяются) в полярных жидкостях (белок в воде) и не набухают в неполярных.
Из-за сродства полимера с растворителем при набухании и растворении большая часть растворителя «связывается» в сольватные (гидратные) оболочки. Особенно это характерно для полярных макромолекул в водной среде. И поскольку макромолекулы обладают большой поверхностью, то для неограниченного набухания (растворения) даже в лиофильной системе требуется достаточное количество жидкости. Иначе процесс набухания может остановиться на стадии ограниченного набухания, т.е. образования студня.
ВЫСАЛИВАНИЕ: Высаливание – это процесс осаждения белков с помощью концентрированных растворов солей. Для высаливания чаще всего используют соли Na2SO4, (NH4)2SO4, фосфаты. Высаливание наиболее эффективно в ИЭТ белка, что и используется для её определения. Учитывая механизм осаждающего действия электролитов и других водоотнимающих средств, немецкий биохимик Кройт предложил общую схему высаливания. Схема высаливания по Кройту. спирт, ацетон спирт, ацетон Из схемы видно, что необходимо удалить гидратную оболочку (спиртом или ацетоном) и снять заряд электролитом. Последовательность этих действий не имеет значения. Для осаждения многих белков достаточно большой концентрации одного электролита, особенно сульфатов, которые обеспечивают снятие и заряда, и дегидратацию частицы. Высаливающее действие электролитов зависит от способности их ионов гидратироваться. Ученый Гофмейстер установил последовательность высаливающего действия анионов и катионов. Лиотропный ряд анионов: SO4 2– > F– > (цитрат) 3– > (тартрат) 2– > (ацетат) – > Сl – > NO3 – > Br– > CNS– Лиотропный ряд катионов: Li+ > Na+ > K+ > Rb+ > Cs+ > Mg2+ > Ca2+ > Sr2+ > Be2+ Процесс высаливания используется для приготовления некоторых лечебных сывороток и противокоревого α-глобулина, а также для разделения белков на фракции при биологических исследованиях. электролит электролит большая концентрация электролита + 6 КОАЦЕРВАЦИЯ: При снижении растворимости в растворах ВМС наблюдается коацервация – слияние гидратных оболочек нескольких частиц без объединения самих частиц. Схема коацервации: Капли или слои, образующиеся в результате коацервации, называются коацервантами. В теории происхождения жизни на Земле, разработанной академиком А.И. Опариным, большое значение придается возникновению белковых коацервантов из белковых молекул. 6. ВЯЗКОСТЬ РАСТВОРОВ ВМС. ВЯЗКОСТЬ КРОВИ. Одним из особых свойств растворов ВМС является вязкость. Вязкость (внутреннее трение) – мера сопротивления среды движению. Растворы ВМС не подчиняются основным законам вязкого течения – законам Ньютона и Туазейля, обнаруживая так называемую аномальную вязкость. Вязкость растворов ВМС очень высока в сравнении с растворами низкомолекулярных веществ. Большая вязкость растворов ВМС обусловлена их высокой гидрофильностью, макромолекулы прочно связаны с молекулами растворителя. На вязкость также влияет форма молекул. Если длинные макромолекулы расположены перпендикулярно потоку, то эффект сопротивления наибольший, если вдоль потока – сопротивление наименьшее. При увеличении давления частицы ориентируются вдоль потока и вязкость уменьшается. В более концентрированных растворах полимеров образуются пространственные структурные сетки, увеличивающие вязкость растворов. Вязкость растворов ВМС зависит от концентрации раствора. Для низкомолекулярных веществ эта зависимость выражается уравнением Эйнштейна: η = η0 ( 1 + α С ), где η – вязкость раствора, η0 – вязкость растворителя, α – коэффициент, зависящий от формы частиц, С – концентрация раствора полимера. Увеличение вязкости, связанное с изменением концентрации при растворении полимера характеризуют удельной вязкостью: Штаудингер установил следующую зависимость удельной вязкости от молекулярной массы полимера: ηуд = К М С К - константа, характерная для полимергомологического ряда, М – молекулярная масса, С – концентрация вещества в растворе. Уравнение Штаудингера используют для определения молекулярной массы биополимеров. Вязкость растворов белков зависит от величины рН. Наименьшей вязкостью растворы белков обладают в области изоэлектрической 7 точки, так как макромолекулы свернуты в плотные клубки, оказывающие наименьшее сопротивление течению жидкости. ВЯЗКОСТЬ КРОВИ. Вязкость воды при t° = 20°C составляет 1 мПа × с, а вязкость крови в норме – 4-5 мПа × с. При различных патологиях значения вязкости крови могут изменяться от 1,7 до 22,9 мПа × с. Неоднородность структуры крови, специфика строения и разветвления кровеносных сосудов приводит к сложному распределению вязкости крови, движущейся по сосудистой системе. Вязкость крови зависит от многих факторов: температуры, наличия тромбоцитов и белых кровяных телец (не только при патологии).
Вязкость увеличивается при сгущении крови, т.е. при потере воды. У больных с хроническими формами ишемической болезни сердца вязкость крови повышены, при физических нагрузках она уменьшается. В последние годы в медицинской практике измерение вязкости крови используется для изучения ее реологических свойств при тяжелых интоксикациях. Для измерения вязкости используют специальные приборы – вискозиметры. 7. КОЛЛОИДНО-ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ В РАСТВОРАХ
Решите задачи:
Укажите направление перемещения указанных ВМС при электрофорезе в буферной системе с рН = 5,1.
Ответьте на тесты:
1. Частицы белка в растворе имеют отрицательный заряд, если
2. Частицы белка в растворе имеют нейтральный заряд, если
3. Набуханию способствуют
4. Застудневанию способствует
Из-за сродства полимера с растворителем при набухании и растворении большая часть растворителя «связывается» в сольватные (гидратные) оболочки. Особенно это характерно для полярных макромолекул в водной среде. И поскольку макромолекулы обладают большой поверхностью, то для неограниченного набухания (растворения) даже в лиофильной системе требуется достаточное количество жидкости. Иначе процесс набухания может остановиться на стадии ограниченного набухания, т.е. образования студня.
-
Существенную роль в набухании играет строение макромолекул полимера. Например, полимеры с длинными жесткими цепями и большим количеством полярных групп хорошо набухают, но не растворяются даже в соответствующем растворителе (целлюлоза в воде). Если полимер растворяется в жидкости не достаточно хорошо, то также образуется студень. -
Температура на эти процессы влияет в соответствии с принципом Ле Шателье. Поскольку набухание сопровождается выделением теплоты на первом этапе, то с повышением температуры степень набухания, а также растворимость полимера, уменьшаются. На второй стадии набухание может стать эндотермическим процессом. Следовательно, в этом случае набухание с возрастанием температуры увеличивается. -
Например, если в холодной воде желатина набухает ограниченно, то с повышением температуры - неограниченно, т.е. растворяется. При охлаждении полученного раствора снова образуется студень. Однако скорость набухания (растворения) полимеров с увеличением температуры растет ввиду увеличения скорости диффузии. -
Действие ионов электролитов на набухание полярного ВМС связано с их способностью к гидратации. Поскольку анионы гидратируются больше, чем катионы, то катионы влияют на набухание этих полимеров незначительно. -
По способности уменьшать набухание анионы располагаются в так называемый лиотропный ряд или ряд Гофмейстера (при одном и том же катионе): СNS- < I- < Вr- < NO3- < СI- < СН3СОО- < SO42- -
Ионы СNS- усиливают набухание вследствие того, что, слабо гидратируясь, они хорошо адсорбируются на макромолекулах ВМС. А ионы SO42- процесс набухания тормозят, так как сульфат-ионы сильнее всех анионов этого ряда гидратируются, уменьшая этим количество «свободной» (не связанной в гидратные оболочки) воды. -
Влияние рН среды особенно значительно для высокомолекулярных электролитов (белков, нуклеиновых кислот, производных целлюлозы и крахмала). Минимум набухания отмечается в ИЭТ, поскольку в ней суммарный электрический заряд макромолекул белков и, соответственно, степень их гидратации минимальны. При более низких или более высоких значениях рН увеличивается ионизация функциональных групп, что приводит к расталкиванию одноименно заряженных участков полимерной цепи и ее разрыхлению. Вследствие этого молекулы воды легче проникают в пространство между цепями, что отражается на величине набухания в сторону ее увеличения. -
Количественной характеристикой ограниченного набухания полимеров является степень набухания α, определяемая отношением приращения массы (т - т0) или объема (V- V0) полимера к его первоначальной массе то(объему V0): -
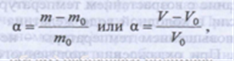
-
-
где т - масса (V- объем) набухшего полимера. -
Набухание полимеров сопровождается возникновением давления, которое назвали давлением набухания(≈ 5∙105-10∙105 Па). Механизм его возникновения подобен механизму возникновения осмотического давления. Это давление легко обнаруживается, когда какое-либо препятствие мешает увеличению объема полимера.
-
Устойчивость растворов биополимеров. Высаливание биополимеров из растворов: определение, механизм и факторы, определяющие этот процесс (температура, электролиты, неэлектролиты).
ВЫСАЛИВАНИЕ: Высаливание – это процесс осаждения белков с помощью концентрированных растворов солей. Для высаливания чаще всего используют соли Na2SO4, (NH4)2SO4, фосфаты. Высаливание наиболее эффективно в ИЭТ белка, что и используется для её определения. Учитывая механизм осаждающего действия электролитов и других водоотнимающих средств, немецкий биохимик Кройт предложил общую схему высаливания. Схема высаливания по Кройту. спирт, ацетон спирт, ацетон Из схемы видно, что необходимо удалить гидратную оболочку (спиртом или ацетоном) и снять заряд электролитом. Последовательность этих действий не имеет значения. Для осаждения многих белков достаточно большой концентрации одного электролита, особенно сульфатов, которые обеспечивают снятие и заряда, и дегидратацию частицы. Высаливающее действие электролитов зависит от способности их ионов гидратироваться. Ученый Гофмейстер установил последовательность высаливающего действия анионов и катионов. Лиотропный ряд анионов: SO4 2– > F– > (цитрат) 3– > (тартрат) 2– > (ацетат) – > Сl – > NO3 – > Br– > CNS– Лиотропный ряд катионов: Li+ > Na+ > K+ > Rb+ > Cs+ > Mg2+ > Ca2+ > Sr2+ > Be2+ Процесс высаливания используется для приготовления некоторых лечебных сывороток и противокоревого α-глобулина, а также для разделения белков на фракции при биологических исследованиях. электролит электролит большая концентрация электролита + 6 КОАЦЕРВАЦИЯ: При снижении растворимости в растворах ВМС наблюдается коацервация – слияние гидратных оболочек нескольких частиц без объединения самих частиц. Схема коацервации: Капли или слои, образующиеся в результате коацервации, называются коацервантами. В теории происхождения жизни на Земле, разработанной академиком А.И. Опариным, большое значение придается возникновению белковых коацервантов из белковых молекул. 6. ВЯЗКОСТЬ РАСТВОРОВ ВМС. ВЯЗКОСТЬ КРОВИ. Одним из особых свойств растворов ВМС является вязкость. Вязкость (внутреннее трение) – мера сопротивления среды движению. Растворы ВМС не подчиняются основным законам вязкого течения – законам Ньютона и Туазейля, обнаруживая так называемую аномальную вязкость. Вязкость растворов ВМС очень высока в сравнении с растворами низкомолекулярных веществ. Большая вязкость растворов ВМС обусловлена их высокой гидрофильностью, макромолекулы прочно связаны с молекулами растворителя. На вязкость также влияет форма молекул. Если длинные макромолекулы расположены перпендикулярно потоку, то эффект сопротивления наибольший, если вдоль потока – сопротивление наименьшее. При увеличении давления частицы ориентируются вдоль потока и вязкость уменьшается. В более концентрированных растворах полимеров образуются пространственные структурные сетки, увеличивающие вязкость растворов. Вязкость растворов ВМС зависит от концентрации раствора. Для низкомолекулярных веществ эта зависимость выражается уравнением Эйнштейна: η = η0 ( 1 + α С ), где η – вязкость раствора, η0 – вязкость растворителя, α – коэффициент, зависящий от формы частиц, С – концентрация раствора полимера. Увеличение вязкости, связанное с изменением концентрации при растворении полимера характеризуют удельной вязкостью: Штаудингер установил следующую зависимость удельной вязкости от молекулярной массы полимера: ηуд = К М С К - константа, характерная для полимергомологического ряда, М – молекулярная масса, С – концентрация вещества в растворе. Уравнение Штаудингера используют для определения молекулярной массы биополимеров. Вязкость растворов белков зависит от величины рН. Наименьшей вязкостью растворы белков обладают в области изоэлектрической 7 точки, так как макромолекулы свернуты в плотные клубки, оказывающие наименьшее сопротивление течению жидкости. ВЯЗКОСТЬ КРОВИ. Вязкость воды при t° = 20°C составляет 1 мПа × с, а вязкость крови в норме – 4-5 мПа × с. При различных патологиях значения вязкости крови могут изменяться от 1,7 до 22,9 мПа × с. Неоднородность структуры крови, специфика строения и разветвления кровеносных сосудов приводит к сложному распределению вязкости крови, движущейся по сосудистой системе. Вязкость крови зависит от многих факторов: температуры, наличия тромбоцитов и белых кровяных телец (не только при патологии).
Вязкость увеличивается при сгущении крови, т.е. при потере воды. У больных с хроническими формами ишемической болезни сердца вязкость крови повышены, при физических нагрузках она уменьшается. В последние годы в медицинской практике измерение вязкости крови используется для изучения ее реологических свойств при тяжелых интоксикациях. Для измерения вязкости используют специальные приборы – вискозиметры. 7. КОЛЛОИДНО-ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ В РАСТВОРАХ
Решите задачи:
-
ИЭТ гемоглобина и альбумина плазмы крови соответственно равны 6,8 и 4,64.
Укажите направление перемещения указанных ВМС при электрофорезе в буферной системе с рН = 5,1.
Ответьте на тесты:
1. Частицы белка в растворе имеют отрицательный заряд, если
-
водородный показатель меньше семи -
водородный показатель больше семи -
водородный показатель равен семи -
водородный показатель меньше изоэлектрической точки -
водородный показатель больше изоэлектрической точки
2. Частицы белка в растворе имеют нейтральный заряд, если
-
водородный показатель больше семи -
водородный показатель равен семи -
водородный показатель меньше изоэлектрической точки -
водородный показатель больше изоэлектрической точки -
водородный показатель равен изоэлектрической точки
3. Набуханию способствуют
-
водородный показатель не совпадает с изоэлектрической точкой -
водородный показатель равен изоэлектрической точки -
высокая температура -
водородный показатель меньше изоэлектрической точки -
водородный показатель больше изоэлектрической точки
4. Застудневанию способствует
-
водородный показатель не совпадает с изоэлектрической точкой -
высокая температура -
низкая концентрация -
линейная форма макромолекул -
сферическая форма макромолекул