Файл: Федеральное агентство по образованию московский государственный университет технологий и управления.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 24.11.2023
Просмотров: 30
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
«Московский государственный университет технологий
и управления имени К.Г. Разумовского»
ОСНОВЫ ОБЩЕЙ И НЕОРГАНИЧЕСКОЙ ХИМИИ
Студент_____________________________________________
Направление_________________________________________
Курс, форма обучения_________________________________
Шифр_______________________________________________
Преподаватели_______________________________________
Соли, образованные сильной кислотой и сильным основанием (NaCl, KNO3, K2SO4 и др.) гидролизу не подвергаются, рН таких
растворов равен 7.
Примеры составления уравнений реакции гидролиза солей: K2S + Н2O ↔ KHS + КОН; S2- + Н2О ↔ HS- + ОН- ; рН>7
А1С13 + Н2O ↔ ALOHCl2 + НCl ; Al3++ Н2О ↔ АlOН2+ + Н+
Опыт 1. Гидролиз солей. К раствору соли в пробирку прибавляют 1-2 капли индикатора и наблюдают изменение окраски.
а) Соль сильного основания и сильной кислоты:
NaCl + Н2О ↔
лакмус окрасился в цвет, реакция среды
рН
б) Соль сильного основания и слабой кислоты.
CH3COONa + H2O ↔
лакмус окрасился в цвет, реакция среды
рН
8
K2CO3 + H2O ↔
лакмус окрасился в цвет, реакция среды
рН
в) Соль слабого основания и сильной кислоты
ZnCl2 + H2O ↔
лакмус окрасился в цвет, реакция среды
рН
г) Соль слабого основания и слабой кислоты
CH3COONH4 + H2O ↔
лакмус окрасился в цвет, реакция среды
Вывод:
Опыт 2. Необратимый гидролиз. При смешивании растворов солей наблюдается образование осадка и выделение газа Al2(SO4)3+ (NH4)2S + Н2O =
Наблюдения и вывод
Упражнения.
-
Какая из приведенных солей при гидролизе не подвергается гидролизу: a) K2S б) NaNO3 в) СгС13 (подчеркните). -
Какая реакция среды будет ггоя растворении в золе соля Fe(NO3)3:
9
а) кислая, б) нейтральная, в) щелочная (подчеркните).
3 Какая из приведенных солей при гидролизе образует кислую
соль:
a) ZnSO4 6) Na3PO4 в) NH4C1 (подчеркните).
4 Составьте молекулярные и ионные уравнения реакций гидролиза
солей: K2S03, Cu(N03)2 ;
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ.
Для облегчения составления правой части уравнения окислительно-восстановительных реакций ниже приводятся таблицы.
Таблица 4.
Важнейшие восстановители.
| Восстановленная форма | Окисленная форма |
| Na2SО3 KNО2 H2S (K2S) HCl (H гал) KJ FeSО4 KCrO2 | Na2SО4 KNO3 S Cl2 (гал2) J2 Fe2(SО4)3 К2СrO4 |
Таблица 5.
Важнейшие окислители.
| Окисленная форма | Восстановленная форма |
| H2SO4 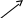 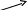 H2O H2O 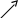 KMnO4 KOH KMnO4 KOH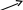 H2SO4 H2SO4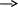 K2Cr2O7 HCl K2Cr2O7 HClKOH KOH | MnSО4 MnО2 K2MnO4 Cr2(SО4)3 CrCl3 KCrO2 |
Таблица 6
Взаимодействие металлов с азотной кислотой.
| Восстановители | Продукты восстановления азотной кислотой | ||
| HNО3 конц. | HNО3 разб. | HNО3 оч.разб. | |
| Малоактивные металлы: Си, Ag, Рb и др. Активные металлы: Mg, Ca, Zn и др. Некоторые металлы: Fe, Сг, Аl и др. | NO2 NO2 Пассивируются | NO N2, N2O NO, N2O | NO NH4NO3 N2 |
Взаимодействие металлов с кислотами и со щелочами. Кусочек металла помещают в пробирку и прибавляют раствор кислоты или щелочи.
Zn + НСl (разб.) =
Сu + НС1 =
Fe + H2SO4 (разб.) =
Fe + H2SO4 (конц.) =
Сu + HNO3 (конц.) =
Сu +
HNO3 (разб.) =
11
Вывод:
Zn + NaOH (конц.) =
Al + NaOH + H2O =
Упражнения. Закончите уравнения реакций и подберите к ним коэффициенты с помощью электронных схем:
1. K2Сг2O7 + HCL =
2. KMnO4 + K2S +H2SО4 =
3. Сl + КОН -> КСlOз + KСl + Н2O =
-'■ Л.
4. КСrO2 + Вr2 + КОН =
5. КМnO4 + FeSO4 + H2SО4 =
12
6.Сu+Н2SO4(конц.) =
7.Mg + HNО3(paзб.) =
8. КМnО4 + HC1 =
ОСНОВЫ ЭЛЕКТРОХИМИИ.
Ряд напряжения металлов.
K/K+ Ba/Ba2+ Ca/Ca2+ Na/Na+ Mg/Mg2+ Al/Al3+ Mn/Mn2+
-2,92 -2,90 -2,87 -2,71 -2,37 -1,70 -1,18
Zn/Zn2+ Fe/Fe2+ Co/Co2+ Ni/Ni2+ Sn/Sn2+ Pb/Pb2+
-0,76 -0,44 -0,28 -0,25 -0,14 -0,13
H22H+ Cu/Cu2+ Ag/Ag+ Hg/Hg2+ Pt/Pt2+ Au/Au+
0,00 +0,34 +0,80 +0,85 +1,20 +1,50
Гальванический элемент.
 Cu Сборка гальванического элемента
Cu Сборка гальванического элемента/ - /Zn/ ZnSO4// Cu SO4/ Cu / +/
13
Составить уравнение для процессов, происходящих на электрода гальванического элемента
э.д.с.= Е° Cu/Cu2+ - Е° Zn/Zn2
Упражнения.
1. Напишите электронные схемы и уравнение реакции, лежащие в основе работы гальванического элемента: Pb/ PbNO3 // AgNО3 / Ag
-
Что подвергается коррозии при повреждении поверхности луженой медной посуды: а) медь, б) олово, в) олово и медь (подчеркните) -
Составьте схемы амфотерной коррозии никелированного железа
4. Какой металл будет являться анодным покрытием для изделий из цинка: а) серебро, б) магний, в) железо (подчеркните)
ЭЛЕКТРОЛИЗ.
Таблица 7.
| КАТОД / - / | АНОД /+/ |
| Восстановление ОФ + ne =ВФ Металлы стоят в ряду напряжения после А1 | Окисление ВФ - ne = ОФ Анионы безкислородные: l-, Br-, Cl-,S2-, Se2- и т.д. |
14
| Е°- 0,83 Men+ + ne = Меo Металлы до А1 (вкл.) Е° - 0,83 2Н2О + 2ê = Н2 + 2ОН- | Аn- - nê = А° Кислородосодержащие анионы в высшей степени окисления: 2Н2О - 4ê = O2 + 4H+ |
Меn+ + nê = Ме° Окислитель
Анод растворимый
Me - nê = Меn+ Восстановитель
Количественные соотношения выделяющихся при электролизе веществ определяются законом Фарадея, из которого следует
m=Э3jt/ 96500
m -масса в гр, Э - эквивалент вещества, j-сила тока в амперах, t- время в
сек, V- объем газа, Vг-экв- объем г-экв газа.
Схемы электролиза
1. Электролиз раствора ZnCl2 инертным анодом
Катод /--/ Zn2++ 2Сl-. Анод /+/
Н2O
Za2+ + 2ê = Zn° 2Сl- - 2ê = С12°
2. Электролиз раствора K2SO4 инертным анодом
. Катод / -12К+ + SO422- Анод / + /
Н2O
2Н2O+2ê = Н2 + 2ОH- 2Н2О - 4ё = O2 + 4H+
Ni
Катод /—/
3. Электролиз раствора с никелевым анодом
Анод / + /
Ni2+ + 2ê = Ni°
Ni° - 2ê = Ni2+
15
Лабораторная работа
Опыт 1. Электролиз раствора сульфата натрия
Na2SО4
Катод/-/ Н2О Анод/+/
Наблюдения:
Опыт 2. Электролиз раствора медного купороса
CuSО4
Катод/-/ Н2О Анод/+/
Наблюдения:
Опыт 3. Электролиз раствора иодида калия.
KI
Катод/-/ Н2O : Анод/+/
Наблюдения:
Опыт 4. Электролиз раствора серной кислоты с применением растворимого анода "
H2SО4
Катод /-/ Н2О Анод/ + /
Наблюдения:
Упражнения. 1.При электролизе какой соли на катоде будет восстанавливаться водород из воды: а) сульфата никеля, б) хлорида калия, в) фосфата калия (подчеркните)
-
Какой процесс произойдет на катоде при электролизе раствора нитрата алюминия: а) А13+ + Зê = А1° б) 2Н20 + 2ê= Н2 + 20НГ, в) 2Н+ + 2ê= Н2 (подчеркните) -
Сколько литров кислорода выделится при пропускании через раствор нитрата серебра 96500 кул электричества: а) 22.4 л, б) 11,2 л, в) 5,6 л (подчеркните) -
Составьте схемы электролиза : а) расплава СаСl2 б) раствора РЬ(NOз)2 с инертным анодом, в) раствора нитрата серебра с серебряным анодом.