Файл: Федеральное агентство по образованию московский государственный университет технологий и управления.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 24.11.2023
Просмотров: 31
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
«Московский государственный университет технологий
и управления имени К.Г. Разумовского»
ОСНОВЫ ОБЩЕЙ И НЕОРГАНИЧЕСКОЙ ХИМИИ
Студент_____________________________________________
Направление_________________________________________
Курс, форма обучения_________________________________
Шифр_______________________________________________
Преподаватели_______________________________________
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ. Строение комплексных соединений по координационной теории
Вернера.
Комплексообразователь
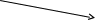

 K4[Fe(CN)6]
K4[Fe(CN)6] лиганды
лигандыВнешняя сфера внутренняя координационное число
комплекса сфера
комплексообразователя
Диссоциация комплексных соединений.
-
По закону сильных электролитов:
К, [ Fe (CN)6 ] → 4К+ + [ Fe (CN)6]4--
-
По закону слабых электролитов:
17
К4 [ Fe (CN)6 ] → 4K+ + [ Fe (CN)6 ]4-
2. По закону слабых электролитов:
[ Fe (CN)6 ] ↔ Fe2+ + 6CN-
3. Выражение константы нестойкости комплексного иона;
К= [Fe2+][CN-]6
[Fe(CN)64-]
Классификация и номенклатура комплексных соединений.
Комплексы бывают катионные, анионные, катионно-анионные и нейтральные в зависимости от заряда комплексного иона
В названиях солей используется общее правило: сначала называют анион, а затем катион в родительном падеже.
Название катиона начинают с координационного числа (используя греческие числительные: 2- ди, 3- три, 4- тетра, 5- пента, 6-гекса) и нейтральных лигандов: Н2О - аква, NНз - аммин, затем отрицательно заряженные лиганды: Сl-- хлоро, О2-- оксо, ОН- -гидроксо,NO2- -нитро, CN- - циано, SO42- сульфато и т.д. Последним называют комплексообразователь, в скобках указывая его степень окисления. Комплексообразователь в катионе называют по -русски. Например [Сu (NH
3)4]S04 - сульфат тетраамминмеди /II/
Комплексообразователь в комплексном анионе называют употребляя латинское название элемента с окончанием "ат" впереди ставя его степень окисления.
Например, К2[ Си (CN)4] - тетрациано /II/ купрат калия.
Катноно-анионный комплекс: [ Pt (NH3)4][PtCl4] -тетрахлоро /II/ платинат тетрааминплатины /II/.
В нейтральных комплексах комплексообразователь называют в именительном падеже, а степень окисления его не указывают: [Pt (NH3)2Cl2] - диамминдихлороплатина.
Опыт 1 К 1 мл раствора соли меди прибавляют постепенно по каплям раствор аммиака. Первоначально выпавший осадок
растворяется.
I8
CuCl + NH4OH =
CuOHCl + NH4C1 + NH4OH =
KH=
Наблюдения и вывод:
Опыт 2. Распад комплексных соединений от действия кислот и щелочей.
К растворами комплексных солей, полученных в предыдущем опыте, прибавляют соответственно растворы серной кислоты и щелочи.
[Cu(NH3)4]Cl2+H2SO4 =
Наблюдения:
[Cu(NH3)4]Cl2 + NaOH =
Наблюдения:
Вывод:
Упражнения.
1. Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях:
К2[ Zn (CN)4], Ba2[Ti Сl8], [Co(NH3)4 Cl2]Cl.
Комплексообразователь Степень окисления Координационное
Zn число
19
Ti
Ti
Co
2. Приведите названия следующих комплексных соединений:
Формула КС Название
[Ni(NH3)6]Cl2
[Сг(Н2O)5С1] Сl2
Н2[РtCl6]
К[РtС16
]
[Cu(NH3)4] (ОН)2
К3[А1(ОН)6]
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ.
Класс соединений
Предельные углеводороды
Непредельные углеводороды
Ароматические углеводороды
Спирты
Общая формула
СnН2n+2
CnH2n
СnН2n-2






R-OH
O
Таблица 8 Отдельныепредставители
СН4- метан
СН2 = СН2 - этилен СН≡СН- ацетнлеи
С6Н6-бензол
СН3ОН - метиловый
спирт
С2Н5ОН -этиловый спирт
СН2 -ОН
Альдегиды
СН-ОН глицерин
СН2-ОН
R-C-H
Кислоты


Н2СО - муравьиный
альдегид
СН3СНО - уксусный
альдегид
R-COOH
НСООН- муравьиная
кислота
СН3СООН - уксусная
кислота
20
C17H35COOH -
стеариновая кислота
Простые эфиры R-O-R С2Н5-O-С2Н5 -

 диэтюговый эфир
диэтюговый эфирСложные эфиры О СН3СООС2Н5 - этиловый
R-C – OR1 эфир уксусной кислоты
R - радикал (СН3-, С2Н5-, и др.)
Опыт 1. Восстановительные свойства формальдегида (муравьиного альдегида). К раствору нитрата серебра прибавляют по каплям аммиак до растворения осадка, а затем несколько капель раствора альдегида. Пагревают.Иа стенках пробирки образуется налет серебряного зеркала.
2 [Ag(NH3)2]OH + Н2СО → 2Ag + НСООН + NH4OH + NH3
Опыт 2. Образование диэтилового эфира (демонстрация).
H2SO4
 C2H5OH
C2H5OHнагревание
Опыт 3. Получение уксусной кислоты. К раствору ацетата натрия в пробирке прибавляют несколько капель крепкой серной кислоты. Обнаруживают запах "уксуса".
CH3COONa+H2SO4→
Наблюдения:
Опыт 4. Действие калиевых солей на мыло. К мыльному раствору прибавляют несколько капель хлорида кальция.
C17H35COONa + СаС12 →
Наблюдения:
Опыт 3. Получение уксусно-этилового эфира (демонстрация).
21
СН3СООН + C2H5OH →
Наблюдения:
УГЛЕВОДЫ.
Углеводы делятся на три группы:
С6Н12О6- моносахариды ( глюкоза, фруктоза);
С12Н22О11 - дисахариды ( сахароза, мальтоза);
/C6H10O5/n - полисахариды (крахмал, клетчатка).
Опыт 6. Действие аммиачного раствора окиси серебра на моносахариды (аналогично опыту I )
О
СН2ОН-/СНОН/4 - C+ Ag2O →
Н
Наблюдения:
БЕЛКИ.

 Белки - природные высокомолекулярные азотсодержащие
Белки - природные высокомолекулярные азотсодержащиеорганические соединения, состоящие из смеси различных аминокислот,
соединенных друг с другом при помощи пептидных связей - СО - NII-
При разложении (гидролизе) белков образуются аминокислоты:
НС1 О

 Белок R-CH-C-OH
Белок R-CH-C-OHнагревание
NH2
Опыт 7. Качественные реакции на белки. При нагревании яичного белка происходит его свертывание.
нагревание
 Белок
БелокСНзСООН
22
Ксантопротеиновая реакция:
t◦C
 Белок желтая окраска
Белок желтая окраска+ HNO3
Упражнения.
1.Что называется δ и π связью? Сколько δ и π связей в молекулах этилена и ацетилена?
2. Как из этилового спирта получить уксусную кислоту? Какой промежуточный продукт при этом образуется? Составьте уравнения реакций.
3. Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения: карбид кальция → ацетилен уксусный альдегид → уксусная кислота → уксусно-метиловый эфир.
4. Напишите уравнение реакции омыления жира.
ВЫСОКОМОЛЕКУЛЯРНЫЕ ОРГАНИЧЕСКИЕ ВЕЩЕСТВА. (ПОЛИМЕРЫ).
Полимерами называют органические вещества, состоящие из больших гибких молекул с характерным для них цепным строением. Существуют два метода получения полимеров:
23
1. Полимеризации, при которых получают соединения, имеющие
тот же состав, что и у исходного вещества ( мономера), но с большей
молекулярной массой.
Например, реакция получения полипропилена:

 n СН2 CH -СН3-СН-
n СН2 CH -СН3-СН-СH3 СН3 n
2. Поликонденсация : реакции соединения мономеров в
макромолекулу, сопровождающиеся одновременным выделением
какого-либо низкомолекулярного вещества (например, Н2О).
Получение капрона:
n NH2 - /СН2/5 – СООН [- NH- /СН2/5 - СО -]n + nН2ОА
аминокапроновая капрон
кислота
Упражнения.
1. Получение фенолформальдегидной смолы
OH OH OH OH













 + HCOH + CH2 + H2O
+ HCOH + CH2 + H2O












фенол формальдегид фенол фенолформальдегидная смола
2. Напишите уравнение реакции полимеризации этилена
(СН2=СН2)
3. Напишите уравнение реакции полимеризации винилхлорида (СН2=СНС1)
4. Напишите уравнение реакции полимеризации стирола (С6Н5СН=СН2)
24
5. Напишите уравнение реакции полимеризации метилметакрилата
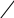 СН3
СН3  СН2=С
СН2=ССООСН3
6. Напишите уравнение реакции полимеризации бутадиена (CH2=CH- СН=СН2)
7. Напишите формулу фторопласта. Какое применение он находит в пищевой промышленности?
8. Полиамидное волокно анид (нейлон) получают из продукта поликонденсации гексаметилендиамина NH2 - /СН2/6 - NH2 и адипиловой кислоты НООС- /СН2/4СООН. Составьте уравнение этой реакции.
1 2 3