Файл: Лабораторная работа 2 Решение задач на газовые смеси.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 04.12.2023
Просмотров: 12
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Лабораторная работа №2 «Решение задач на газовые смеси»
Цель работы: ознакомиться с теоретическим материалом, определить потребную поверхность нагрева.
Ход работы:
-
Оформить разворот в тетради по лабораторным работам, лабораторную работу № 2, соблюдая все требования ЕСКД и ГОСТов. -
Ознакомиться с теоретическим материалом. -
Произвести расчёты по примеру, исходя из данных на последнем листе работы. -
Ответить на контрольные вопросы. -
Защитить работы, устно отвечая на вопросы, задаваемые преподавателем.
Критерии оценивания:
-
Грамотно оформленный штамп + 3 эскиза на выбор + правильно произведенный расчёт+ ответ на 3 ответа на устные вопросы, задаваемые преподавателем- оценка «3». -
Грамотно оформленный штамп + 3 эскиза на выбор + правильно произведенный расчёт+ ответ на 4 на устные вопросы, задаваемые преподавателем- оценка «4». -
Грамотно оформленный штамп + 3 эскиза на выбор + правильно произведенный расчёт+ ответ на 5-6 на устных вопросов, задаваемых преподавателем- оценка «5».
Паpциальное давление — давление, которое имел бы газ, если бы он один при той же температуре занимал весь объем смеси.
Способы задания смеси. Состав газовой смеси может быть задан массовыми, объемными или молярными долями.
Массовой долей называется отношение массы отдельного компонента к массе смеси/
Объемная доля представляет собой отношение приведённого объема газа к полному объему смеси/
Пpиведенным называется объем, который занимал бы компонент газа, если бы его давление и температура равнялась давлению и температуре смеси.
Газовой смесью называется такая смесь газов, у которой компоненты не вступают между собой в химические реакции. Все компоненты в смеси имеют одинаковую температуру, равную температуре смеси.
Парциальным объёмом называется объём, который занимал бы компонент, обладая давлением и температурой смеси.
Закон Дальтона. Важнейшая особенность, характеризующая газовые смеси, выражается законом Дальтона. Согласно этому закону каждый газ
, входящий в состав газовой смеси, ведёт так, как будто он один при данной температуре занимаем весь объём смеси.
Задача и пример её решения. Смесь состоит из 5 кг углекислого газа СО2, 2 кг оксида углерода СО и 13 кг азота N2. Давление смеси 100 кПа и температура 400 К. Определить массовые и объёмные доли компонентов, мольную массу и газовую постоянную смеси, общий объём, удельный объём и плотности смеси при параметрах смеси и нормальных условиях, прианальные объёмы компонентов при параметрах смеси и их прианальные давления.
Масса смеси. М=МСО2+МСО+МN2 = 5+2+13=20 кг.
mCO2=
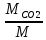 =
=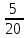 =0,25 кг
=0,25 кгmCO=
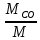 =
=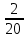 =0,1 кг
=0,1 кгmN2=
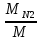 =
=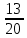 =0,65 кг
=0,65 кгМольная масса смеси:
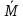 =
=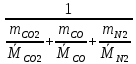 =
=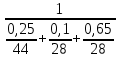 = 30,9 кг/моль
= 30,9 кг/мольОбъёмные доли компонентов:
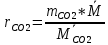 =
=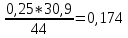
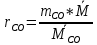 =
=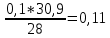
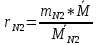 =
=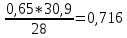
Газовая постоянная смеси:
R=
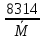 =
=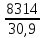 =269 Дж/кг*К
=269 Дж/кг*КОбщий объём смеси:
V=
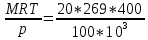 =21,5 м3
=21,5 м3Удельный объём при условиях смеси:
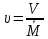 =
=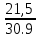
=
Плотность при условиях смеси:
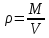 =
=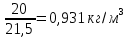
Удельный объём при нормальных условиях:
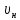 =
=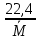 =
=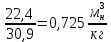
Плотность при нормальных условиях
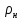 =
=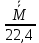 =
=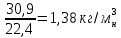
Парциальные объёмы компонентов при условии смеси:
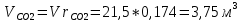
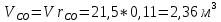
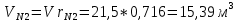
Объём смеси при нормальных условиях:
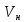 =
=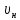 *М=0,725*20=14,5
*М=0,725*20=14,5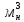
Парциальные давления компонентов:
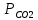 =
= 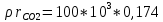 =17,4 кПа
=17,4 кПа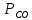 =
= 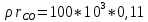 =11 кПа
=11 кПа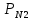 =
= 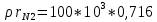 =71,6 кПа
=71,6 кПа