ВУЗ: Казахский национальный медицинский университет им. С.Д. Асфендиярова
Категория: Шпаргалка
Дисциплина: Химия
Добавлен: 05.02.2019
Просмотров: 12562
Скачиваний: 45

химические свойства кремнийорганических со-
единений.
1. Замещение атомов галогена в алкил (арил) гало
генсиланах. Например, диалкилдихлорсиланы гидро
лизуются до соответствующих гидроксильных соеди
нений — силоколов:
2. Расщепление связей кремний—углерод под дей
ствием как электрофильных, так и нуклеофильных реа
гентов. В данной реакции используется нуклеофиль
ный реагент:
другие органические производные элементов
IV группы: олово и свинецорганические соедине
ния. Получают их действием алкилгалогенидов на
сплав свинца или олова с натрием или действием ре
актива Гриньяра на хлориды этих металлов:
поливинилтриметилсилан
nCH
2
=CHSi(CH
3
)
3
[—CH
2
—CH(Si(CH
3
)
3
)]
винилтриметилсилан
диметилсилокол
(CH
3
)
2
SiCl
2
+ HOH (CH
3
)
2
Si(OH)
2
+ 2HCl
диметилдихлорсилан
триэтилхлорсилан
(C
2
H
5
)
4
Si + Cl
2
(C
2
H
5
)
3
SiCl + С
2
Н
5
С1
тетраметилолово
4С
2
Н
5
С1 + Рb + Na (C
2
H
5
)
4
Pb + 4NaCl
тетраэтилсвинец
4С
2
Н
5
С1 + SnCl
4
(CH
3
)
4
Sn + 4MgCl
2

171. Органические сОединения
ЭлементОв V группы
Элементы V группы: фосфор, мышьяк, сурьма,
висмут.
представители. Производные фосфора: алкил
фосфины RРН
2
, R
2
PH, R
3
P, алкилфосфоновые кисло
ты RPO(OH)
2
, эфиры фосфоновых кислот.
физические свойства. Фосфины — жидкости, не
растворимые в воде и обладающие сильным запахом,
ядовиты. С кислотами образуют хорошо кристаллизу
ющиеся фосфониевые соли, которые по своему стро
ению аналогичны аммониевым солям [RPH
3
]X, где
R — алкильный радикал, Х — анион кислоты:
СH
3
PH
2
+ HCl [СH
3
P+H
3
]Cl
–
метилфосфин хлорид
метилфосфин
получение.
1. Металлоорганический синтез из трихлорфосфина:
2. Алкилфосфоновые кислоты получают взаимо
действием алкилхлорфосфинов с водой:
3. Взаимодействие фосфина с альдегидами (p =
= 150–300 мм рт. ст.):
PCl
3
+ RMgCl RPCl
2
+ MgCl
2
алкилдихлорфосфат
R
2
PCl + 2H
2
O RP(OH)
2
+ 2HCl
РН
3
+ 4СН
2
О + Н
2
О [P(CH
2
OH)
4
]+OH
–
муравьиный
альдегид
тетракис-(гидроксиметил)-
фосфонийгидроксид

4. Фосфоновые кислоты получают взаимодействи
ем трихлороксида фосфора с металлоорганическими
соединениями:
химические свойства.
Фосфониевые соли разлагаются уже при действии
воды. Фосфины — сильно ненасыщенные соединения
и легко окисляются с воспламенением. При действии
азотной кислоты первичные и вторичные фосфины
превращаются в соответствующие фосфиновые кис
лоты, а третичные — в окиси фосфинов.
алкилфосфоновая кислота
R(P=O)Cl
2
+ Н
2
О R(P=O)(OH)
2
172. Органические сОединения
перехОдных металлОв
Неустойчивые алифатические и более устойчивые
ароматические производные образуют Сu, Ag, ряд
устойчивых к действию влаги и кислот соединений
образуют Au и Pt.
Основные типы металлоорганических произ-
водных переходных металлов.
1. карбонилы металлов — химические соедине
ния окиси углерода СО с металлами. Некоторые из
них находят практическое применение: карбонилы
никеля Ni(CO)
4
и железа Fe(CO)
5
служат для получения
химически чистых металлов.
Карбонилы металлов могут иметь различное строе
ние, причем в состав молекулы могут входить один и
более атомов металла, например: Fe(CO)
5
, Ni(CO)
4
,
Fe
2
(CO)
9
, W(CO)
6
, Fe
3
(CO)
12
.
получают действием оксида углерода на металл
или соль металла, как правило, под давлением и в
присутствии восстановителя: Fe + 5CO → Fe(CO)
5
.
химические свойства.
Молекулы оксида углерода, входящие в состав кар
бонилов, легко обмениваются в различных реакциях
на алкильные радикалы, галогены и др.:
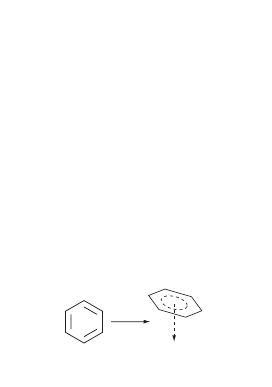
бензолтрикарбонил хрома
+ 2СО
Cr(CO)
5
+
Cr(CO)
3
гексакарбонил

2. р-комплексы переходных металлов (Ni, Pd, Pt,
Cu, Ag, Аu) с алкенами и алкадиенами. Связь меж
ду атомом металла и алкеном осуществляется как за
счет у, так и за счет рсвязей:
1) в безводной среде формируется димерный
Пкомплекс 2PdCl
2
+ 2H
2
C = CH
2
→ (C
2
H
4
PdCl
2
)
2
;
2) в водной среде образуется гидратированный
Пкомплекс PdCl
2
+ H
2
C = CH
2
+ H
2
O →
→ C
2
H
4
PdCl
2
• H
2
O.
Комплексные соединения переходных металлов яв
ляются уникальными катализаторами (реакции поли
меризации).
3. металлоарены.
Представляют собой ркомплексы переходных ме
таллов с бензолом и другими ароматическими соеди
нениями. Металлоарены имеют различное строение.
4. металлоцены.
Действием реактива Гриньяра на FeCl
3
Посон
(1951) получил первый представитель соединений
ряда металлоценов — ферроцен, представляющий
собой сандвичеобраз ную структуру, в которой между
двумя циклопентадиенильными кольцами (анионами)
находится атом железа в двухвалентном состоянии.