Файл: Лекция 3 Химическая кинетика. Целью исследований химической кинетики является.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 06.12.2023
Просмотров: 31
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ЛЕКЦИЯ № 3 Химическая кинетика.
Целью исследований химической кинетики является:
1. экспериментальное определение скорости реакции и её зависимости от различных факторов,
2. выявление механизма реакции, т.е. числа стадий и природы образующихся в этих стадиях промежуточных веществ.
Скорость реакции измеряется количеством вещества, реагирующего в единице объёма в единицу времени – (гомогенные реакции) или на единице поверхности раздела фаз (гетерогенные реакции). Отсюда размерности скоростей реакции гомогенной
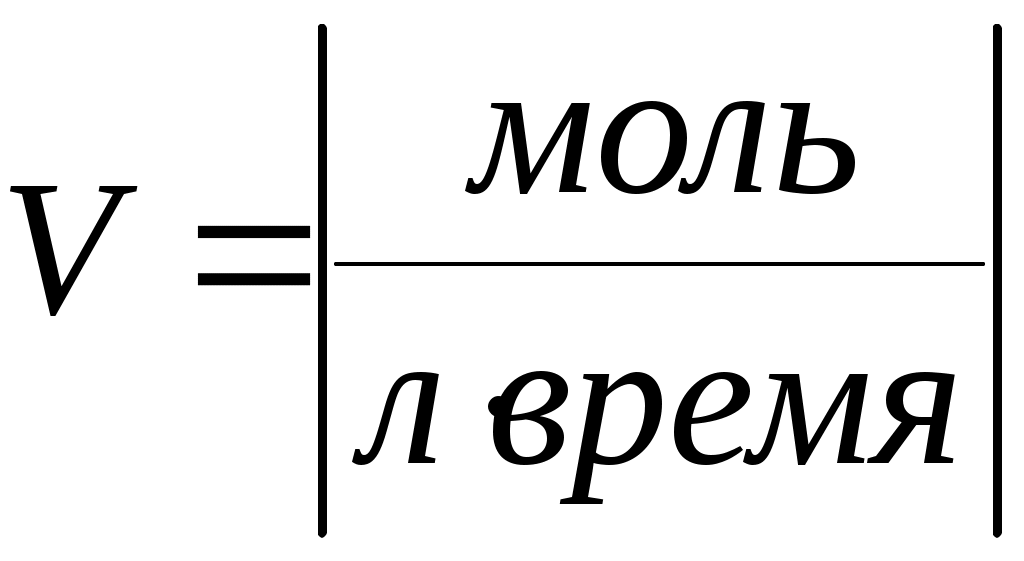 ; гетерогенной
; гетерогенной 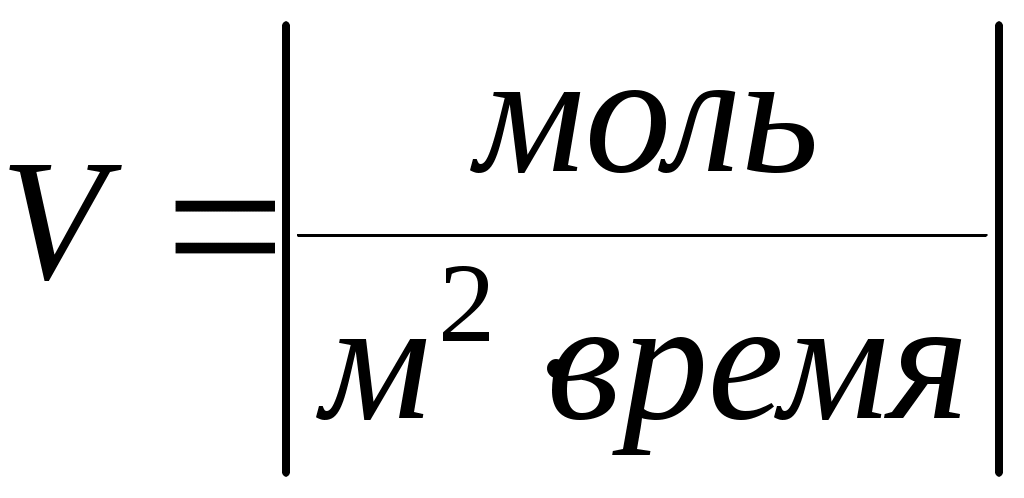 .
.Практически скорость гомогенной реакции может быть измерена изменением концентрации исходного вещества или продукта реакции в единицу времени. Этим процессам отвечают диаграммы:
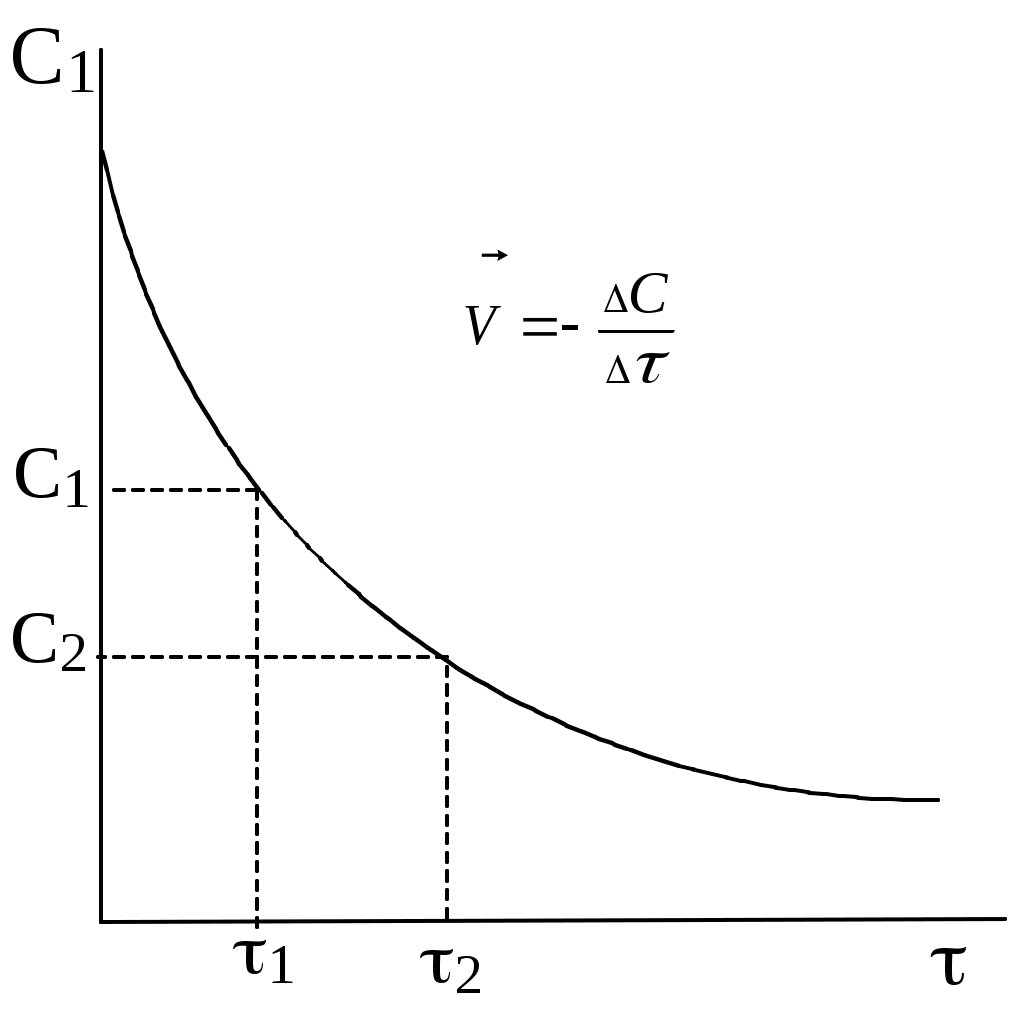
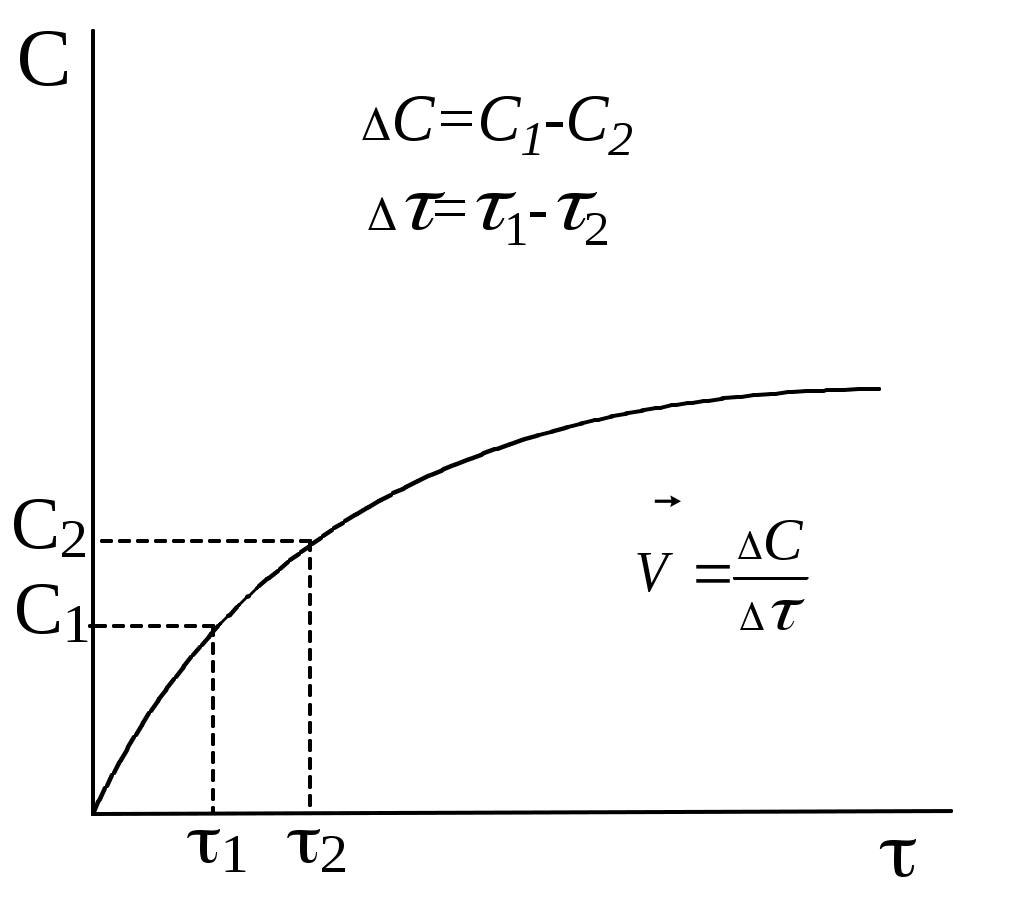
Следует отметить, что даже в самом малом ограниченном участке приведённых кривых скорость реакции непостоянна и, поэтому, истинной скоростью реакции называется скорость в данный момент времени. Она представляет собой первую производную от концентрации по времени
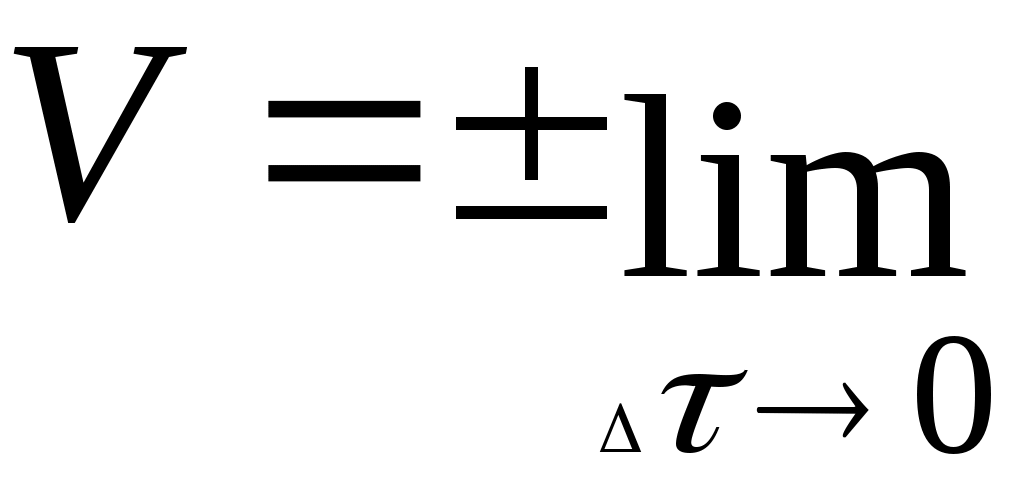
Факторы, влияющие на скорость химических реакций
1. Природа веществ
2. Концентрации веществ (давление - для газофазных реакций)
3. Температура
4. Энергия активации
5. Катализаторы
6. Степень измельчённости – для гетерогенных процессов
Остановимся на некоторых из них.
1. Природа веществ.
С наибольшей скоростью реагируют вещества (неорганические и органические) с ионными, полярными ковалентными связями. Взаимодействия органических веществ с ковалентными малополярными связями протекают значительно медленнее.
2. Концентрация реагентов.
Количественная связь между скоростью и концентрацией реагирующих веществ описывается законом действия масс (К.М.Гульберг, П.Вааге, 1864-1867 г.г.), современная трактовка которого такова: при постоянной температуре скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, в степенях, равных порядку реакции по этим веществам. Порядок реакции по каждому из реагентов определяют экспериментально.
Для гомогенной реакции
кинетическое уравнение в соответствии с законом действия масс имеет вид
где k– константа скорости реакции, которая численно равна скорости реакции при концентрации каждого из реагентов равной 1 моль/л. Константа скоростихарактеризует скорость данного процесса при данной температуре; не зависит от концентрации реагентов, зависит от температуры – возрастает с ростом температуры. α и β – порядок реакций по веществам соответственно AиB.
Только для одностадийных реакций, при которых исходные вещества без каких-либо промежуточных соединений превращаются в продукты реакции величины α и β равны стехиометрическим коэффициентам.
Например
В случае гетерогенных реакций в уравнения закона действия масс вводятся концентрации только веществ, которые находятся в газовой фазе или в растворе. Например, для реакции C(тв) + O2
Порядок и молекулярность реакции.
Порядок реакции – число, равное сумме показателей степеней концентраций реагентов в кинетическом уравнении.
Порядок реакции может принимать значения от 0 до 3, включая дробные величины.
Для простоты рассмотрим только реакции целочисленного порядка.
Реакции нулевого порядка – такие реакции, скорость которых не зависит от концентрации реагента. Большая часть из них являются гетерогенными реакциями, протекающими на поверхности металла. Например, реакция разложения аммиака на H2 и N2 на поверхности вольфрама является реакцией нулевого порядка, т.е. её скорость на протяжении всего процесса не зависит от концентрации NH
3.
Реакции первого порядка
2H2O2
4AsH3
Несоответствие между кажущейся молекулярностью и порядком реакции объясняется тем, что в многостадийных реакциях промежуточные превращения осуществляются с несопоставимыми скоростями. Наиболее медленная стадия определяет скорость реализации процесса превращения исходных веществ в конечные продукты. Эта стадия называется лимитирующей.
Например, 2N2O5
Реакция протекает в две стадии:
N2O5
N2O5 + N2O3
Скорость второй бимолекулярной реакции несравненно выше скорости первой – мономолекулярной, следовательно, скорость превращения N2O5 в NO2 определяется первой стадией, чему соответствует уравнение
Важной величиной является время полупревращения (τ1/2) реакции, т.е. время, в течение которого концентрация реагента уменьшается в 2 раза по сравнению с исходным значением. В фармакинетике это обозначается термином “период полуэлиминации”.
Распределение лекарственного препарата, введенного в кровоток, подчиняется кинетике первого порядка.
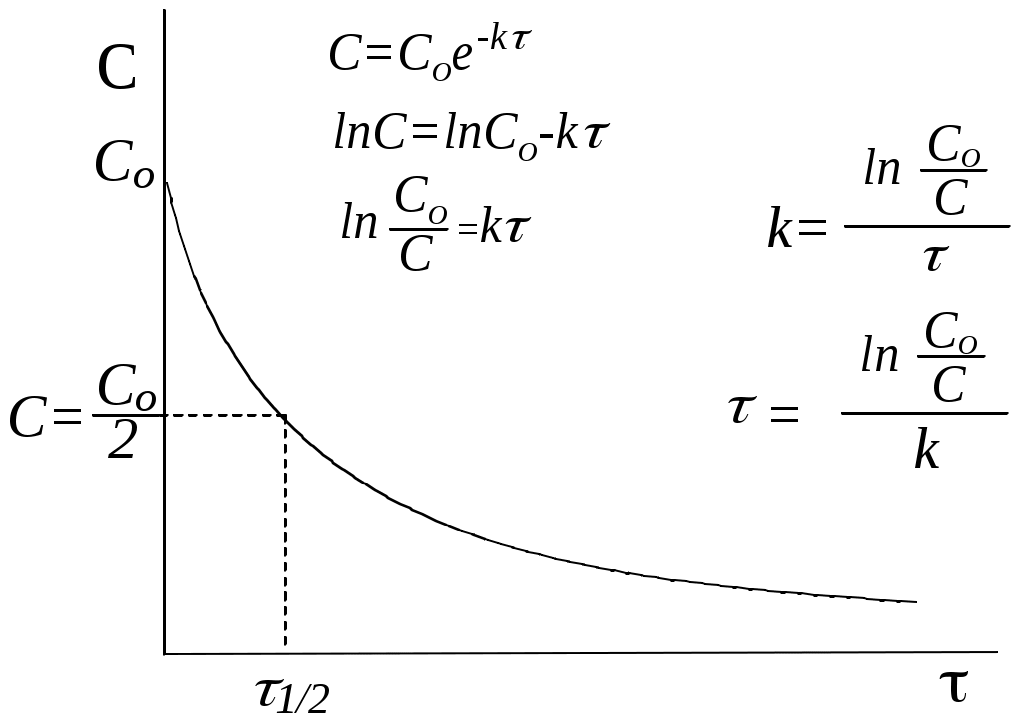
Подставляя значение
k1 – константа скорости реакции
Реакции второго порядка – самый распространённый тип реакций. Вот примеры таких реакций
2NO2
H2 + I2
CO + Cl2
2N2O
Реакции третьего порядка крайне редки.
Исходя из всего вышесказанного, можно определить размерности констант реакций различных порядков.
| Порядок реакции | Размерность константы |
| нулевой | моль |
| первый | время1 |
| второй | л |
| третий | л2 |
Молекулярность реакции.
Под молекулярностью реакции понимают число молекул, которые одновременно взаимодействуют, осуществляя элементарный акт химического превращения. В отличие от порядка реакции молекулярность не может быть ни нулевой, ни дробной.
Мономолекулярные – в элементарном акте химического превращения участвует одна молекула:
н-C4H10
цикло-C3
H6
Ca(HCO3)2
Бимолекулярные – реакции, в которых химическое превращение осуществляется путём взаимодействия двух молекул:
CO + Cl2
H2 + I2
PH3 + B2H6
Тримолекулярные реакции – их известно очень немного. Очевидно, что вероятность одновременного соударения трёх молекул в реакционном пространстве очень мала и, поэтому, тримолекулярные реакции идут крайне медленно.
Примеры тримолекулярных реакций:
2NO + O2
2NO + Cl2
Реакций более высокой молекулярности не существует.
3. Температура.
Влияние температуры на скорость химических реакций упрощённо описывается правилом Вант-Гоффа (1884 г.): при повышении температуры на каждые 10 градусов скорость гомогенной реакции возрастает примерно в 2-4 раза. Математически это правило записывается так:
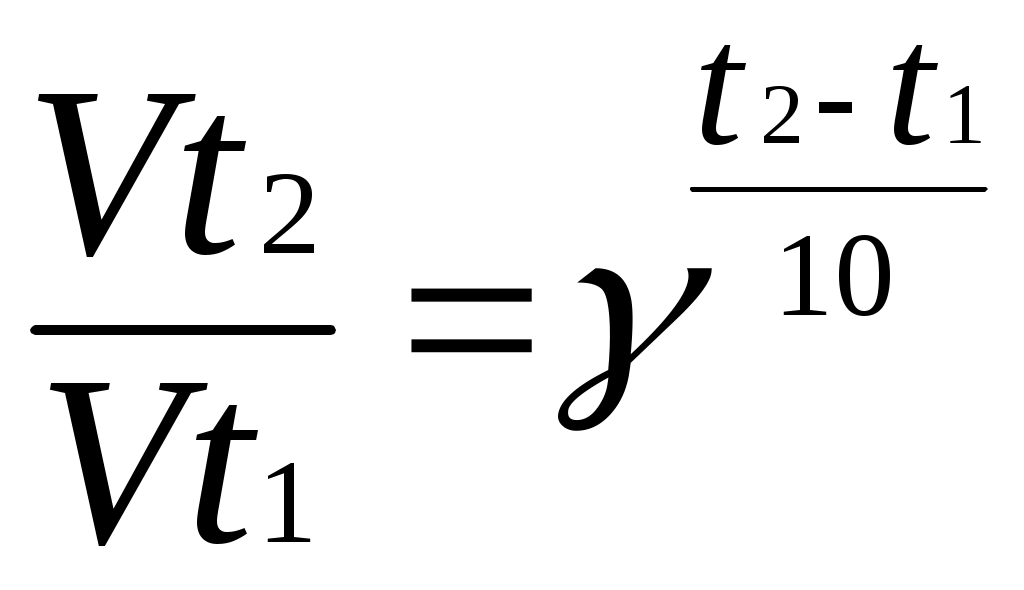 ,
, где
γ – температурный коэффициент Вант-Гоффа
4. Энергия активации.
Более строгую математическую зависимость скорости реакции от температуры описывает уравнение С.Аррениуса (1889 г.), который исходил из предположения, что не всякое столкновение молекул в реакционном объёме заканчивается результативно, т.е. с образованием нового вещества. По С.Аррениусу продукт реакции образуется только при столкновении молекул, обладающих некоторым избытком кинетической энергии, т.е. активных (реакционноспособных) молекул.