Файл: Цель работы Определение теплового эффекта процессов растворения соли и гидратообразования. Оборудование и реактивы.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 07.12.2023
Просмотров: 70
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Цель работы
Определение теплового эффекта процессов растворения соли и гидратообразования.
Оборудование и реактивы
Стеклянный толстостенный (батарейный) стакан объемом 500 мл – 1 шт. Фарфоровый или стеклянный внешний стакан объемом 750 мл – 1 шт. Стеклянная палочка для перемешивания – 1 шт. Кристаллизатор – 1 шт. Штатив с лапками – 1 шт. Термометр Бекмана – 1 шт. Мерный цилиндр объемом 25 или 50 мл (для определения объема ртутного баллона термометра Бекмана) – 1 шт. Мерный цилиндр объемом 500 мл – 1 шт. Секундомер – 1 шт. Весы лабораторные – 1 шт. Безводная соль (сульфат меди, никеля, цинка или магния). Кристаллогидрат этой соли.
Краткие теоретические сведения
Гидратация — присоединение молекул воды к молекулам или ионам.
Кристаллогидраты — кристаллы, содержащие молекулы воды и образующиеся, если в кристаллической решётке катионы образуют более прочную связь с молекулами воды, чем связь между катионами и анионами в кристалле безводного вещества.
Термометр Бекмана или метастастический термометр — ртутный термометр со вложенной шкалой, используемый, в отличие от других термометров, не для измерения термодинамической температуры, а для измерения небольших разностей температур. Градус Бекмана = Градус цельсия.
Экзотермическая реакция - химическая реакция или ядерная реакция, сопровождающаяся выделением теплоты.
Эндотермическая реакция - химическая реакция или ядерная реакция, сопровождающаяся поглощением теплоты.
Энтальпия - термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Результаты опыта
Таблица 1. Протокол работы
| Наменование соли | Сульфат меди |
| Химическая формула безводной соли | CuSO4 |
| Масса безводной соли, г | 5 |
| Химическая формула кристаллогидрата | CuSO4·5H2O |
| Масса кристаллогидрата, г | 7,8 |
| Масса стеклянной палочки и внутреннего стакана калориметрической установки mст., г. | 124,1 |
| Объем ртутного баллона термометра VHg, мл | 3 |
| Объем воды, мл | 300 |
| Масса воды, г | 300 |
| Масса раствора безводной соли: 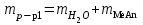 , г , г | 305 |
| Масса раствора кристаллогидрата, г: 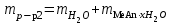 | 307,8 |
Таблица 2. Измерения температуры
| № | Время, с | Температура, Б | |
| Безводная соль | Кристаллогидрат | ||
| 1 | 0 | 3,91 | 3,76 |
| 2 | 30 | 3,92 | 3,77 |
| 3 | 60 | 3,92 | 3,78 |
| 4 | 90 | 3,93 | 3,79 |
| 5 | 120 | 3,94 | 3,79 |
| 6 | 150 | 3,94 | 3,80 |
| 7 | 180 | 3,95 | 3,81 |
| 8 | 210 | 3,96 | 3,82 |
| 9 | 240 | 3,97 | 3,83 |
| 10 | 270 | 3,98 | 3,84 |
| 11 | 300 | 3,99 | 3,85 |
| 12 | 330 | 4,50 | 3,85 |
| 13 | 360 | 4,65 | 3,83 |
| 14 | 390 | 4,69 | 3,79 |
| 15 | 420 | 4,71 | 3,73 |
| 16 | 450 | 4,72 | 3,72 |
| 17 | 480 | 4,73 | 3,71 |
| 18 | 510 | 4,73 | 3,70 |
| 19 | 540 | 4,74 | 3,70 |
| 20 | 570 | 4,74 | 3,70 |
| 21 | 600 | 4,75 | 3,70 |
| 22 | 630 | 4,75 | 3,70 |
| 23 | 660 | 4,75 | 3,71 |
| 24 | 690 | 4,75 | 3,71 |
| 25 | 720 | 4,76 | 3,71 |
| 26 | 750 | 4,76 | 3,71 |
| 27 | 780 | 4,76 | 3,71 |
| 28 | 810 | 4,76 | 3,71 |
| 29 | 840 | 4,76 | 3,71 |
| 30 | 870 | 4,76 | 3,71 |
| 31 | 900 | 4,76 | 3,71 |
Расчётные формулы
Теплоёмкость калориметрической установки по уравнения, Дж/К:
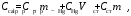 (1.1)
(1.1)где Cр-р – удельная теплоемкость раствора, 4,18 Дж/гК; mp-p – масса раствора во внутреннем стакане, г; СHg – объемная теплоемкость ртути и стекла, 1,92 Дж/см3К, VHg – объем баллона термометра, содержащего ртуть, мл; Cст – удельная теплоемкость стекла, 0,79 дж/гК; mcт. – общая масса стеклянных частей калориметрической установки, г.
Интегральная теплота растворения безводной соли и кристаллогидрата:
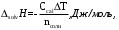 (2.2)
(2.2)где nсоли – количество вещества соли (безводной или кристаллогидрата), моль.
Тепловой эффект процесса гидратации:
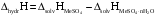 (2.3)
(2.3)Относительная инструментальная ошибка:
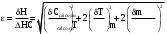 (2.4)
(2.4)Относительную погрешность расчетного определения теплоемкости системы
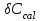 обычно принимают равной 3 %; погрешность определения температуры определяется ценой деления термометра Бекмана (0,005°Б), массы – технической характеристикой весов (0,01 г).
обычно принимают равной 3 %; погрешность определения температуры определяется ценой деления термометра Бекмана (0,005°Б), массы – технической характеристикой весов (0,01 г).Обработка экспериментальных данных
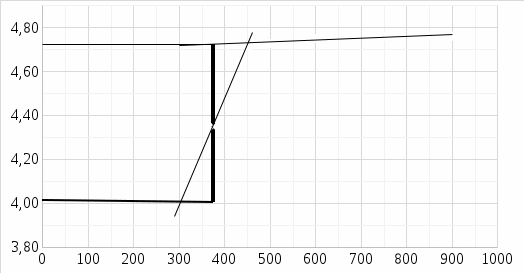
Рис. 1. Изменение температуры в опыте с безводной солью
ΔTMeSO4 = 4,72 -4,00 = 0,72 Б
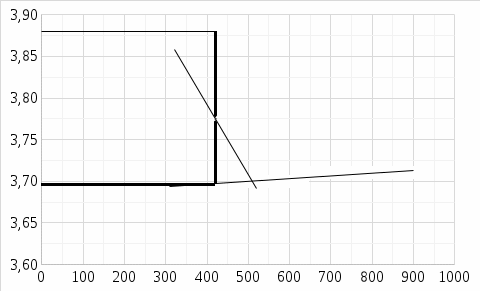
Рис. 2. Изменение температуры в опыте с кристаллогидратом
ΔTMeSO4·nH2O = 3,70 - 3,88= -0,18 Б
-
Теплоемкость калориметрической установки:-
Для опыта с безводной солью
-
Сcal1 = Cр-рmp-p + СHgVHg + Cстmст= 4,18 Дж/(гК) * 305г + 1,92 Дж/(млК) *3 мл + 0,79 Дж/(гК) * 124,1г = 1378,688Дж/К
-
Для опыта с кристаллогидратом
Сcal2 = Cр-рmp-p + СHgVHg + Cстmст= 4,18 Дж/(гК) * 307,8г + 1,92 Дж/(млК) *3 мл + 0,79 Дж/(гК) * 124,1г = 1390,03Дж/К
-
Количество веществ щёлочи и кристаллогидрата, использованных в опыте:
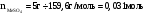
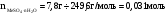
-
Тепловые эффекты реакций:-
Для опыта с безводной солью
-
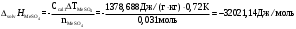
-
Для опыта с кристаллогидратом
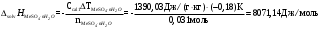
-
Тепловой эффект процесса гидратации:
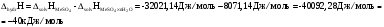
-
Относительная инструментальная ошибка:-
Для опыта с безводной солью
-
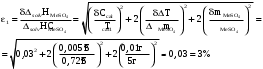
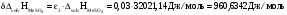
-
Для опыта с кристаллогидратом
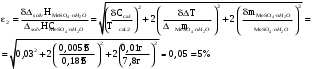
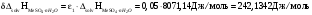
-
Абсолютная погрешность определения теплоты гидратации:
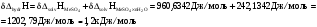
Окончательный результат:
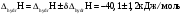
Вывод
В ходе лабораторной работы был определён тепловой эффект процесса гидратации медного купороса и растворения кристаллогидрата. По графикам изменения температуры можно убедиться, что процесс растворения безводной соли является экзотермическим (сопровождается повышением температуры), а растворение кристаллогидрата - эндотермическим, энергия расходуется на разрыв связей между молекулами H2O и CuSO4.
Было выяснено, что при образовании кристаллогидратов энтальпия системы понижается.
Изменение температуры в обоих опытах происходило постепенно, что связано с растворимостью солей. В опыте с кристаллогидратом в начальном периоде температура растёт быстрее ввиду того, что стакан после промывки немного охладился и получал теплоту из окружающей среды более активно.