Добавлен: 12.12.2023
Просмотров: 29
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение высшего образования

«САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ»
Кафедра общей и физической химии
Отчёт по лабораторной работе:
«ЛАБОРАТОРНАЯ РАБОТА № 3. СВОЙСТВА ХРОМА И МАРГАНЦА»
Выполнил: ст. группы ТХ-22-1 /Мафула нахя Э./
(должность) (подпись) (Ф.И.О)
Проверил: / ./
(должность) (подпись)
1.Название работы: ЛАБОРАТОРНАЯ РАБОТА № 3. «СВОЙСТВА ЭЛЕМЕНТОВ ХРОМ И МАРГАНЕЦ»
2.Цель работы: изучение химических свойств хрома и марганца.
3.Уравнения реакция, ответы на вопросы:
ХРОМ
Опыт 2. Получение и свойства гидроксида хрома (III)
1.Сr2(SO4)3 + 6NaOH = 2Cr(OH)3 + 3Na2SO4
Cr3+ + 3OH- = Cr(OH)3 – зеленый осадок
2. 2Cr(OH)3 + 3H2SO4 = Сr2(SO4)3 + 3H2O
Cr(OH)3 + 3H+ = Cr3+ + 3H2O – зеленый раствор
3. Cr(OH)3 + 3HCl = СrCl3 + 3H2O – фиолетово-зеленый раствор
Cr(OH)3 + 3H+ = Cr3+ + 3H2O
Разница в окрасках растворов обусловлена образование различных аква-комплексов([Cr(H2O)6]Cl3 – фиолетовый, Cr2(SO4)3*H2O – темно-зеленый) в соединениях, которые, в свою очередь из-за разного строения которых меняется диапазон поглощаемого спектра излучения.
4. Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Cr(OH)3 + 3OH- = [Cr(OH)6]3- - изумрудный раствор
Опыт 3. Гидролиз солей хрома(III)
А) Cr2(SO4)3 + 2H2O ↔ 2Cr(OH)SO4 + H2SO4
Cr3+ + H2O ↔ CrOH2+ + H+ - индикаторная бумага насыщенно-оранжевая, ближе к красному. pH = 2. Основание слабое. К
г = 1,86*10-16/1,02*10-10 = 1,82*10-6.
Б) Cr2(SO4)3 + 3Na2S + 6H2O = 2Cr(OH)3 + 3Na2SO4 + 3H2S
2Cr3+ + 3S2- + 6H2O = 2Cr(OH)3 + 3H2S – выделение газа с запахом тухлых яиц, выпадение осадка
Cr2(SO4)3 + 3Na2CO3+ 3H2O = 2Cr(OH)3 + 3Na2SO4 + 3CO2
2Cr3+ + 3CO32- + 3H2O = 2Cr(OH)3 + 3CO2 – выделение бесцветного газа
Опыт 5. Переходы между формами хромовой кислоты
А) K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
Cr2O72- + 2OH- = 2CrO42- + H2O – переход из оранжевого в желтый.
Б) 2K2CrO4 + 2H2SO4 = K2Cr2O7 + 2KHSO4 + H2O
2CrO42- + 2H+ = Cr2O72- + H2O – переход в оранжевый
Опыт 6. Малорастворимые хроматы
1) K2CrO4 + BaCl2 = BaCrO4 + 2KCl – желтый светлый осадок
Ba2+ + CrO42- = BaCrO4
2) K2CrO4 + Hg2(NO3)2 = Hg2CrO4 + 2KNO3 – оранжевый насыщенный осадок светлый осадок
2Hg+ + CrO42- = Hg2CrO4
3) K2CrO4 + Pb(NO3)2 = PbCrO4 + 2KNO3 – желтый насыщенный осадок
Pb2+ + CrO42- = PbCrO4
4) 2AgNO3 + K2Cr2O7 = Ag2Cr2O7 + KNO3
2Ag+ + Cr2O72- = Ag2Cr2O7 – красный осадок. Со временем рассыпается с изменением окраски:
Ag2Cr2O7 = Ag2CrO4 + CrO3 – оксид хрома – насыщенно-красный
Опыт 4. Окислительные свойства хроматов.
1. K2Cr+62O7 + 4H2SO4 + 3Na2S+4O3 → K2SO4 + 3Na2S+6O4 + Cr+32(SO4)3 + 4H2O – зеленая окраска раствора
 Cr2O72- + 14H+ + 6ȇ → 2Cr3+ + 7H2O
Cr2O72- + 14H+ + 6ȇ → 2Cr3+ + 7H2OSO32- + H2O - 2ȇ → SO42- + 2H+
Окислитель: K2Cr2O7
Восстановитель: Na2SO3
2. K2Cr+62O7 + 7H2SO4 + 3Na2S-2 → K2SO4 + 3Na2SO4 + Cr+32(SO4)3 + 3S0 +7H2O – зеленая окраска раствора, помутнение раствора из-за выпадения осадка коллоидной серы
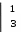 Cr2O72- + 14H+ + 6ȇ → 2Cr3+ + 7H2O
Cr2O72- + 14H+ + 6ȇ → 2Cr3+ + 7H2OS2- - 2ȇ → S0
Окислитель: K2Cr2O7
Восстановитель: Na2SO3
3. K2Cr+62O7 + 7H2SO4 + 6Fe+2SO4 → K2SO4 + Cr+32(SO4)3 + 3Fe+32(SO4)3 + 7H2O – образование буроватого раствора
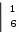 Cr2O72- + 14H+ + 6ȇ → 2Cr3+ + 7H2O
Cr2O72- + 14H+ + 6ȇ → 2Cr3+ + 7H2OFe2+ - 1ȇ → Fe3+
Окислитель: K2Cr2O7
Восстановитель: FeSO4
Марганец
Опыт 2. Осаждение марганца.
А) 1. MnSO4 + Na2CO3 = MnCO3 + Na2SO4
Mn2+ + CO32- = MnCO3 – выпадение белого осадка плотного. Буреет на воздухе:
2. 2MnCO3 + O2 = 2MnO2 + 2CO2 – бурый осадок
Опыт 1. Гидроксид марганца(II)
MnSO4 + 2NaOH = Mn(OH)2↓ + 2Na2SO4
Mn2+ + 2OH- = MnOH)2↓ - образование осадка бледно-розового. Буреет на воздухе :
2Mn(OH)2 + O2 = 2MnO(OH)2
3.Mn(OH)2 + 2HCl = MnCl2 + H2O – растворение студенистого бледн-роз осадка
Mn(OH)2 + 2H+ = Zn2+ + H2O
Опыт 3. Окислениемарганца (II)
2Mn2+SO4 + 16HNO3 + 5NaBi5+O3 = 2HMn+7O4 + 5Bi3+(NO3)3 + NaNO3 + 7H2O + 2Na2SO4
Mn2++ 4H2O - 5e = MnO4 + 8H+ | 2
Bi5+O3- + 6H+ + 2e = Bi3+ + 3H2O | 5
Раствор розово-красного цвета.
Опыт 5. Окислительные свойства KMnO4
А) 1. 2KMn+7O4 + 8H2SO4 + 10KI-1 → 5I20↓ + 6K2SO4 + 2Mn+2SO4 + 8H2O – окрашивание р-ра в бурый
MnO4- + 8H+ + 5ȇ → Mn2+ + 4H2O
2I- - 2ȇ → I20
Окислитель: KMnO4
Восстановитель: KI
2. 2KMn+7O4 + 3H2SO4 + 5Na2S+4O3 → K2SO4 + 5Na2S+6O4 + 2Mn+2SO4 + 3H2O – обесцвечивание раствора
 MnO4- + 8H+ + 5ȇ → Mn2+ + 4H2O
MnO4- + 8H+ + 5ȇ → Mn2+ + 4H2OSO32- + H2O - 2ȇ → SO42- + 2H+
Окислитель: KMnO4
Восстановитель: Na2SO3
3. 2KMn+7O4 + 8H2SO4 + 10Fe+2SO4 → K2SO4 + 5Fe+32(SO4)3 + 2Mn+2SO4 + 8H2O – окрашивание р-ра в бурый

MnO4- + 8H+ + 5ȇ → Mn2+ + 4H2O
2Fe2+ - 2ȇ → 2Fe3+
Окислитель: KMnO4
Восстановитель: FeSO4
Б)1. 2KMn+7O4 + 3Na2S+4O3 + H2O = 2Mn+4O2↓ + 2KOH + 3Na2S+6O4 - выпадение бурого осадка
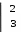 MnO4- + 2H2O + 3ȇ → MnO2 + 4OH-
MnO4- + 2H2O + 3ȇ → MnO2 + 4OH-SO32- + H2O - 2ȇ → SO42- + 2H+
Окислитель: KMnO4
Восстановитель: Na2SO3
2. 2KMn+7O4 + 3Mn+2SO4 + 2H2O = 5Mn+4O2↓ + K2SO4 + 2H2SO4 – выпадение бурого осадка
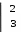 MnO4- + 2H2O + 3ȇ → MnO2 + 4OH-
MnO4- + 2H2O + 3ȇ → MnO2 + 4OH-Mn2+ + 2OH- - 2ȇ → MnO2 + 2H+
Окислитель: KMnO4
Восстановитель: MnSO4
B)1. 2KMn+7O4 + Na2S+4O3 + 2NaOH = K2Mn+6O4 + Na2Mn+6O4 + Na2S+6O4 + H2O – изменение цвета раствора на темно-зеленый.
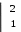 MnO4- + 1ȇ → MnO42-
MnO4- + 1ȇ → MnO42- SO32- + H2O - 2ȇ → SO42- + 2H+
Окислитель: KMnO4
Восстановитель: Na2SO3
Опытно можно заключить, что наивысшая окислительная способность у реакции оскиления в кислой среде.
ВЫВОД К ЛАБОРАТОРНОЙ РАБОТЕ:
Хром и марганец – металлы, которые человечество использует чаще всего в изготовлении некоторых сплавов и легированных сталей(марганец используется при раскислении стали, хром при хромировании). Хром используют для образивных веществ(триокись хрома), а марганец зачастую имеет применение в медицине(в виде пермарганата)
В ходе выполнения работы я изучил свойства элементов хром и марганнц. При наблюдении было установлено, что между эти элементы обладают уникальными свойствами, которые оюбъясняются их электронными строениями. Благодаря большому количеству валентных электронов на внешнем электронном уровне эти элементы могут являться сильнейшими оксилителями. Следует отметить, что наиболее рациональная форма существования некоторых соединений для этих элементов – с промежуточной степенью оксиления
Можно заключить, что проделанные мною опыты подтверждают положения переодического закона Д.И. Менделеева. Считаю, что цель работы достигнута.